CST Studie, 2. Teil der Studie
Inhaltsverzeichnis
- 1 Toxizitätsdaten
- 1.1 Letale Auswirkungen von Imidacloprid und seinen Derivaten auf Bienen
- 1.1.1 Mortalität infolge einer Intoxikation durch eine einzige Applikation der aktiven Substanz.
- 1.1.1.1 a) Verfügbare Resultate
- 1.1.1.1.1 Imidacloprid
- 1.1.1.1.2 Imidacloprid-Methaboliten
- 1.1.1.2 b) Validität der Resultate
- 1.1.1.2.1 Imidacloprid
- 1.1.1.2.2 Metaboliten
- 1.1.1.3 c) Kommentare und Perspektiven
- 1.1.1.1 a) Verfügbare Resultate
- 1.1.2 Mortalität infolge einer chronischen Intoxikation (wiederholte Applikation der aktiven Substanz).
- 1.1.2.1 a) Verfügbare Resultate
- 1.1.2.1.1 Toxizitätsstudie für Imidacloprid und seine Metaboliten
- 1.1.2.2 b) Validierungskriterien
- 1.1.2.3 c) Validierte Studien
- 1.1.2.3.1 Toxizitätsstudie für Imidacloprid
- 1.1.2.3.2 Toxizitätsstudie für die Metaboliten von Imidacloprid
- 1.1.2.4 d) Kommentare und Perspektiven
- 1.1.2.1 a) Verfügbare Resultate
- 1.1.1 Mortalität infolge einer Intoxikation durch eine einzige Applikation der aktiven Substanz.
- 1.2 Subletale Auswirkungen von Imidacloprid und seinen Derivaten auf Bienen
- 1.2.1 Laborstudien
- 1.2.1.1 Resultate disponibles
- 1.2.1.1.1 Liste der Studien
- 1.2.1.1.2 Gemessene Auswirkungen:
- 1.2.1.1.3 Die Resultate
- 1.2.1.2 b) Validierungskriterien
- 1.2.1.3 c) Validierte Resultate
- 1.2.1.4 d) Kommentare und Perspektiven
- 1.2.1.1 Resultate disponibles
- 1.2.2 In Tunneln und Flugkäfigen durchgeführte Studien
- 1.2.2.1 a) Verfügbare Resultate
- 1.2.2.1.1 Liste der Studien
- 1.2.2.1.2 Beobachtete Auswirkungen
- 1.2.2.1.3 Resultate
- 1.2.2.2 b) Die Validierungskriterien
- 1.2.2.3 c) Validierte Resultate
- 1.2.2.4 a) Verfügbare Resultate
- 1.2.2.4.1 Liste der Studien:
- 1.2.2.4.2 Beobachtete Auswirkungen:
- 1.2.2.4.3 Resultate
- 1.2.2.5 b) Validierungskriterien
- 1.2.2.6 c) Validierte Resultate
- 1.2.2.7 d) Kommentare und Perspektiven
- 1.2.2.1 a) Verfügbare Resultate
- 1.2.3 Zusammenfassung und Empfehlungen in Bezug auf die Toxizitätsdaten von Imidacloprid und seinen Metaboliten
- 1.2.3.1 Akute Intoxikation (1 einzige Applikation)
- 1.2.3.1.1 Zusammenfassung der Validierungskriterien
- 1.2.3.1.2 Intoxikation durch orale Applikation
- 1.2.3.1.3 Intoxikation durch topische Applikation
- 1.2.3.2 Chronische Intoxikation
- 1.2.3.2.1 Zusammenfassung der Validierungskriterien
- 1.2.3.2.2 Intoxikation infolge wiederholter oraler Applikation der Metaboliten von Imidacloprid (Chronische Intoxikation)
- 1.2.3.3 Subletale Auswirkungen
- 1.2.3.3.1 Laborstudien, Intoxikation durch wiederholte Applikation
- 1.2.3.3.2 Studien im Flugkäfig und in Tunneln, Intoxikation durch wiederholte Applikation
- 1.2.3.3.3 Freilandstudien
- 1.2.3.1 Akute Intoxikation (1 einzige Applikation)
- 1.2.1 Laborstudien
- 1.1 Letale Auswirkungen von Imidacloprid und seinen Derivaten auf Bienen
Toxizitätsdaten
Die Auswertungsarbeiten der Studien über Dosierung und Toxizität systemischer Insektizide haben eine sehr gründliche Analyse der von dem CST erhaltenen Berichte und Publikationen notwendig gemacht.
Letale Auswirkungen von Imidacloprid und seinen Derivaten auf Bienen
Mortalität infolge einer Intoxikation durch eine einzige Applikation der aktiven Substanz.
a) Verfügbare Resultate
Imidacloprid
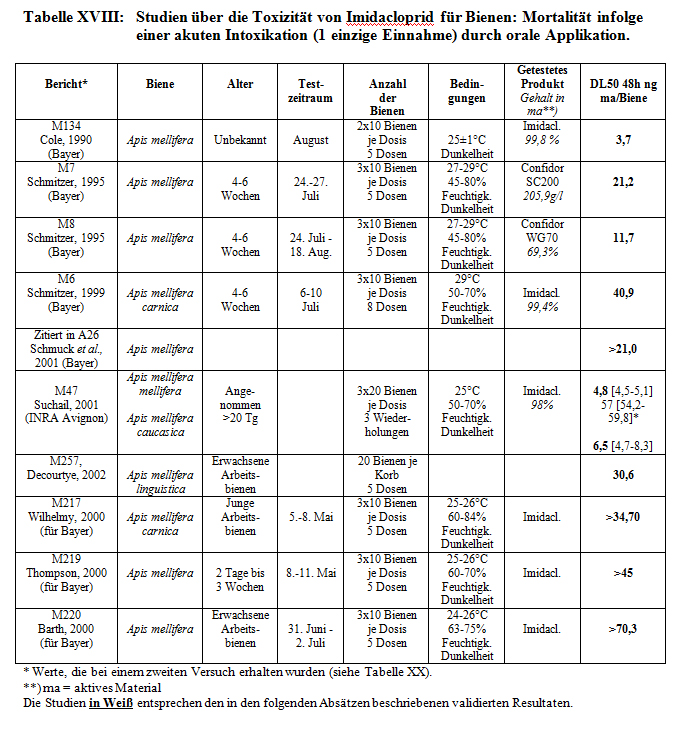
Studien zur Prüfung der akuten oralen Toxizität wurden durchgeführt:
- von der Firma Bayer (1990, M134, 1995, M7 und M8 und 1999, M6,),
- von verschiedenen Labors im Auftrag der Firma Bayer (2000 M217, M219, M220),
- von dem INRA in Avignon (Suchail, 2001, M47)
- von dem INRA in Bures-sur-Yvette (Decourtye im September 2000, M191).
Alle Resultate werden in Tabelle XVIII dargestellt.
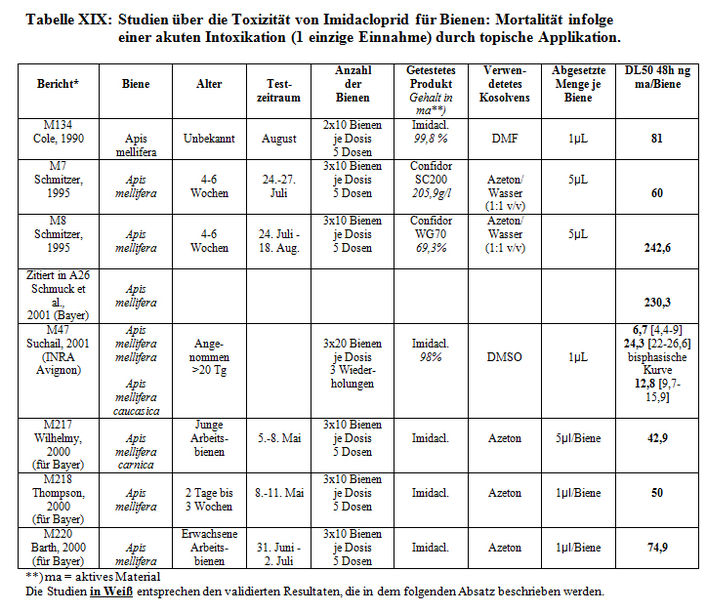
Studien zur Prüfung der akuten Kontakttoxizität wurden ebenfalls durchgeführt:
- von der Firma Bayer (1990, M134, 1995, M7;),
- von Labors für die Firma Bayer (2000, M217, M218, M220)
- und von dem INRA in Avignon (Suchail, 2001, M47).
Alle Resultate werden in Tabelle XIX dargestellt.
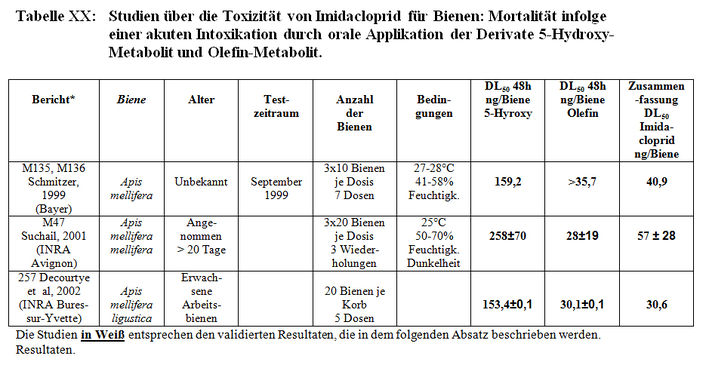
Imidacloprid-Methaboliten
Nach einer Saatgutbeizung wird Imidacloprid, je nach Pflanzenart, mehr oder weniger vollständig in zahlreiche Metaboliten metabolisiert, die gemeinsam den Zyklus 2-Chlorpyridin haben. Die Toxizität jedes Metaboliten wird durch das Feststellen des DL50-Wertes bewertet. Der DL50-Wert von Imidacloprid dient als Referenz für den Vergleich der DL50-Werte der Metaboliten.
Die Studien wurden durchgeführt: – von der Firma Bayer (Schmitzer, 1999, M135 und M136), – von dem INRA in Avignon (Suchail, 2001, M47) – von dem INRA in Bures-sur-Yvette (Decourtye, 2002, M257). Alle Resultate werden in Tabelle XX dargestellt.
b) Validität der Resultate
Die Mortalitätstests zur Prüfung auf akute Intoxikation (1 einzige Einnahme/Applikation) entsprechen den OCDE-Direktiven Nr. 213 (Toxizität infolge einer oralen Applikation) und Nr. 214 (Toxizität infolge einer Kontaktapplikation) und werden somit unter standardisierten Bedingungen durchgeführt, die die von dem CST geforderten Validierungskriterien erfüllen. Aus diesem Grund wurden alle Studien validiert. Die in den verschiedenen Studien verwendeten Protokolle wurden in den Anhängen XIV und XV. synthetisiert
Imidacloprid
Bei der akuten Toxizität (1 Applikation) durch orale Applikation, belaufen sich die für 48 Stunden von und für Bayer erhaltenen DL50-Werte auf 3,7 bis >70,3 ng aktives Material je Biene und diejenigen des INRA in Avignon auf 4,8 bis 57 ng Imidacloprid je Biene, je nach Bienenrasse. Man stellt hier eine große Streuung der erhaltenen DL50-Werte fest, die bei zwei verschiedenen Tests desselben Labors für dasselbe Produkt festgestellt wurden. Darüber hinaus zeigt diese Studie bei den hohen Imidaclopriddosen eine verzögerte Mortalität. Die bei dem INRA, Bures-sur-Yvette erhaltenen DL50-Werte belaufen sich auf 9,7 bis 70 ng aktives Material je Biene.
Bei der akuten Toxizität durch topisch Applikation, belaufen die von und für Bayer erhaltenen DL50-Werte sich auf 6,7 bis 243 ng aktives Material je Biene. Bei den Studien des INRA in Avignon ergeben die Studien zur Prüfung der akuten Toxizität 2 Kurventypen: eine Kurve mit der Relation ‚übliche Dosis/Auswirkung‘ (DL50 von 50 bis 70ng/Biene) und eine biphasische Kurve, die in der Mehrheit der Fälle und insbesondere bei der topischen Intoxikation festgestellt wurde. Diese Antwort folgt einer arithmetischen Progression. Aufgrund dieser Kurve konnte 2 DL50-Werte festgestellt werden: einer zwischen ca. 4 und 6 ng/Biene, der zweite zwischen 22 und 26 ng/Biene. Die Sensibilität der Bienen auf Imidacloprid ist somit bei der oralen Applikation höher als bei einer topischen Intoxikation.
Metaboliten
Da alle standardisierten Protokolle eingehalten wurden, wurden alle Studien validiert. Mit den Metaboliten wurde nur die akute orale Toxizität geprüft. Nur zwei Metaboliten von Imidacloprid, das 5-Hydroxy-Imidacloprid und das Olefin-Derivat weisen eine akute Toxizität für die Biene auf. Die Mortalitätsstudie für Bienen zur Prüfung einer akute Intoxikation durch vier andere Metaboliten (die Derivate 4,5–Dihydroxyl, Guanidin, Urea und 6-Chlornikotinsäure) haben keine Letalität gezeigt (DL50>1000 ng/Biene) (Suchail, 2001, M47).
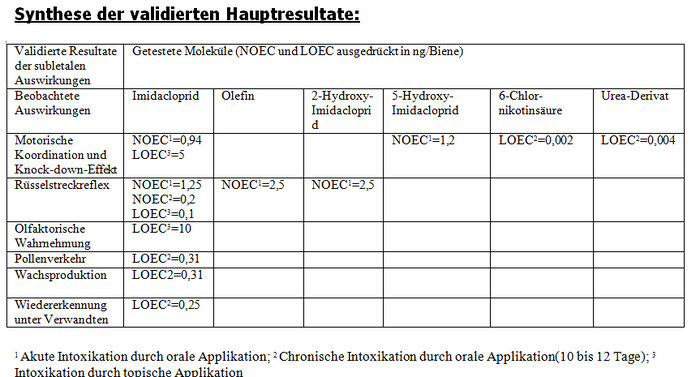
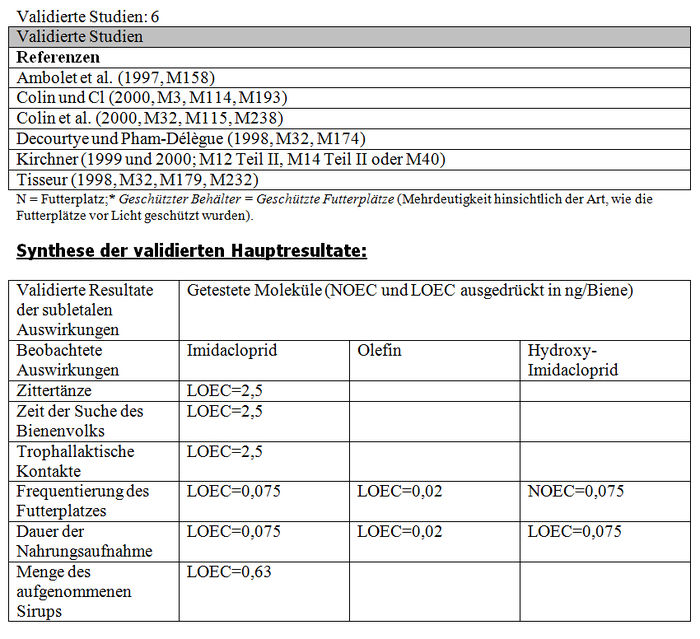
Die DL50-Werte für 48 Stunden, die für das Derivat 5–Hydroxyl validiert wurden, belaufen sich auf 159 ng/Biene (Bayer), 258 ng/Biene (Suchail) und 153 ng/Biene (Decourtye). Für das Derivat Olefin stellt Bayer einen DL50-Wert für 48 Stunden von 28 ng/Biene und Decourtye einen DL50-Wert für 48 Stunden von 30±0,1 ng/Biene fest. Gemäß diesen Resultaten scheint Olefin ebenso toxisch wie das Ausgangsprodukt (41 bis 57 ng aktive Substanz/Biene) zu sein.
c) Kommentare und Perspektiven
Die Resultate, die für die akute Toxizität von Imidacloprid (1 einzige Applikation) durch orale Applikation präsentiert wurden, sind mit einem DL50-Wert von 4 bis 71 ng Imidacloprid je Biene in der gleichen Größenordnung. Alle verfügbaren Studienberichte wurden validiert. Allgemeiner ausgedrückt befinden sich die DL50-Werte für Imidacloprid innerhalb des Spektrums der in der Literatur veröffentlichen Werte: von 3,7 bis >81ng Biene (A24, A26, A28, A35). Ebenso wie bei den Studien über die akute orale Toxizität von Imidacloprid gestattet uns die Konvergenz der erhaltenen DL50-Werte für das Derivat Olefin (30 ng/Biene) und das Derviat 5–Hydroxyl (150-250 ng/Biene), sie als Referenzwerte zu betrachten. Insbesondere wird die Toxizität von Olefin hervorgehoben. Bei den Studien über die akute Toxizität bei topischer Applikation erhält man DL50-Werte von 6,7 bis 240 ng Imidacloprid je Biene. Alle verfügbaren Studien wurden validiert.
Es werden die charakteristischen Eigenschaften der akuten Toxizität von Imidacloprid verzeichnet, und zwar hauptsächlich:
- eine 4 Stunden nach der Intoxikation der Biene beobachtete verzögerte Mortalität;
- das Vorliegen von 2 ansteigenden Phasen in der Relation ‚Dosis-Mortalität‘ (biphasische Kurve) für bestimmte Bienenrassen (hauptsächlich caucasica) bei topischer Intoxikation;
- eine höhere Sensibilität gegenüber Imidacloprid bei oraler Applikation als bei topischer Applikation;
- die starke Entwicklung der Mortalität nach 24 Stunden und eine verzögerte Mortalität bei hoher Dosierung.
Bedauernswerterweise fehlen in der Mehrheit der Studien Vertrauensbereiche und statistische Tests, die den Nachweis eventueller Differenzen zwischen den Kontrollbienen und den mit unterschiedlichen Dosen behandelten Bienen aufzeigen. Ebenso betonen wir die Tatsache, dass nur bei Studie M220 zwei Kontrolltypen verwendet (eine wirkliche Kontrolle mit gesüßtem Wasser und eine „Kontroll-Lösung“ mit gesüßtem Wasser und Azeton, das zum Auflösen von Imidacloprid verwendet wird). Wir stellen uns die Frage nach der Erheblichkeit des DL50-Werts im Fall eines Bienenvolks, bei dem ein Verlust von 50 % der Bienen zum Tod des ganzen Volks führt. Die Experten des CST überprüfen, ob unter Berücksichtigung dieser statistischen und protokollspezifischen Kriterien eine Änderung der OCDE-Direktiven 213 und 214 notwendig ist.
Mortalität infolge einer chronischen Intoxikation (wiederholte Applikation der aktiven Substanz).
a) Verfügbare Resultate
Toxizitätsstudie für Imidacloprid und seine Metaboliten
Die Resultate, über die wir verfügen, stammen:
- von dem Labor für Umwelttoxikologie des INRA in Avignon (Suchail, 2001, M47)
- von dem Labor für vergleichende Neurobiologie bei wirbellosen Tieren des INRA in Bures-sur-Yvette (Decourtye, 1988, 2002, M13, M257, Pham-Delègue und Cluzeau, 1998, M32 mit den Modifikationen M162 und Pham-Delègue, 2000, M33).
- von den Labors, die von der Firma Bayer damit beauftragt wurden, ergänzende Studien entsprechend den Resultaten von Suchail durchzuführen, die eine Toxizität von Imidacloprid und seinen Metaboliten bei einer längeren Exposition nachgewiesen hatten (Barth, 2000, M220, M227; Bruhnke, 2000, M228; Kling, 2000, M222, M224, M230, M231; Thompson, 2000, M218, M219, M221, M226; Wilhelmy, 2000, M217, M225, M229). Leider beziehen sich diese Berichte ausschließlich auf die Daten zur chronischen Toxizität bei den Metaboliten Urea und 6 Chlornikotinsäure.
Die verschiedenen verfügbaren Studien werden in Tabelle XXI und XXII dargestellt.
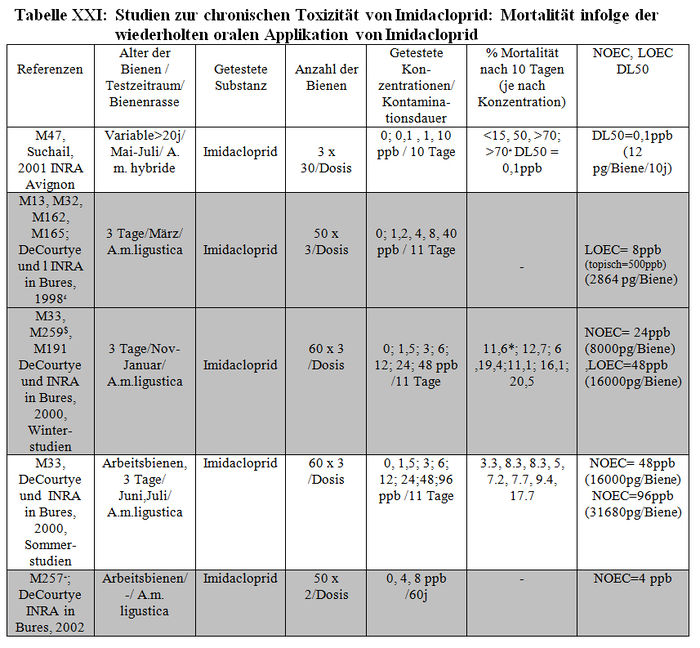
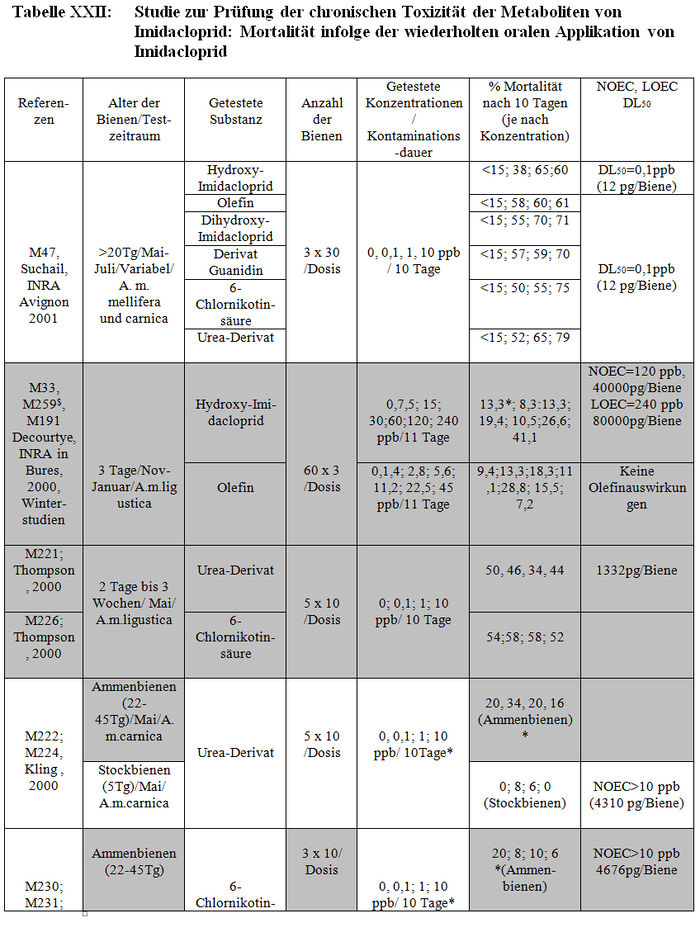
-: fehlende Daten; #: von den Grafiken erhaltene Schätzungen;$ Problem mit den aktiven Substanzen, die sich bei den Metaboliten als weniger konzentriert erweisen, weil das Vorhandensein von Olefin und Hydroxi-Imidacloprid in den Sirupen dieser Studien die fehlende Stabilität der Substanzen in den Sirupen dieser Studie nahe legen; *Abbruch des Experiments nach 4 Tagen aufgrund der hohen Versuchsbienenmortalität; +: Studien, die von Bayer wegen der nicht zufälligen Verteilung der Bienen für ungültig erklärt wurden. Die NOEC-,LOEC- und DL50-Werte werden in ppb und in pg der aktiven Substanz/Biene während 10 Tagen ausgedrückt. Die Studien in Weiß entsprechen den validierten Resultaten, die in dem folgenden Absatz beschrieben werden.
b) Validierungskriterien
Im Gegensatz zu den Tests auf akute Toxizität, die für die Marktzulassung eines Pestizids erforderlich sind und für die stardisierte Protokolle existieren, sind Tests auf chronische Toxizität nicht erforderlich und es wurde kein standardisiertes Protokoll erstellt. Mangels einer spezifischen Direktive haben wir uns dazu entschieden, auf die von der Arbeitsgruppe „Bienenschutz“ der ICPBR (Internationale Kommission für die Beziehung zwischen Honigbienen und Pflanzen) publizierten Richtlinien OEPP/EPPO 2001 und auf die von den Mitgliedern der Kommission für Biologische Tests (CEB) des französischen Pflanzenschutzvereins etablierte Methode Nr. 95 Bezug zu nehmen:
• Nr. 1: Die Bienen müssen unter Bedingungen gehalten werden, die ihren Umweltbedingungen ähneln (nicht aus dem geheizten Bienenhaus stammen): im Dunkeln in einem klimatisierten Behälter bei 25°C±2°C und einer relativen Feuchtigkeit zwischen 50 und 70 %. • Nr. 2: Bienenalter und -rasse müssen ebenso angegeben werden wie die Methode der Erfassung, der Probenahme und das Testdatum. • Nr. 3 Die Testeinheit ist ein Käfig mit 10 Bienen. Jeder Test muss eine Kontrollbehandlung, eine Behandlung mit jeder zu testenden aktiven Substanz (mindestens 3 verschiedene Konzentrationen) beinhalten. Jede Behandlungsmodalität umfasst mindestens 3 Bienenkörbe, die Tests sind mindestens dreimal zu wiederholen. Der Test muss über eine Dauer von etwa 10 Tagen durchgeführt werden. • Nr. 5 Die Mortalität stellt die abhängige Variabel dar. Sie muss regelmäßig (mindestens alle 24 Stunden) registriert werden, um ihre Entwicklung im Zeitverlauf zu bewerten. In den Kontrollkäfigen darf sie nach 10 Behandlungstagen höchstens 15 % der ursprünglichen Bienenpopulation ausmachen. Dies impliziert die Verwendung von Kolonien in guter physiologischer Verfassung. Die Resultate müssen als DL50 10 Tage verzeichnet werden. Die Bruttodaten müssen in dem Testprotokoll aufgeführt werden.
c) Validierte Studien
Mangels des standardisierten Protokolls erstellt jedes Labor sein eigenes. Aus diesem Grund überprüfen wir die Studienprotokolle sorgfältig und erbitten von den Autoren der Protokolle verschiedener Studien schriftlich weitere Präzisionen (Anhänge XVI, XVII, XVII, XIX)*) (*)Anm. d. Übers.: XVII wird zweimal genannt). Dank der verschiedenen Antworten haben wir eine Synthese der verschiedenen Studienprotokolle erstellt (siehe Anhänge XX und XXI). Trotz dieser unterschiedlichen Protokolle schließen sich die verschiedenen Arten der Studien nicht aus. Sie können die Sensibilitätsunterschiede der Bienen reflektieren, insbesondere je nach ihrem Alter, ihrer Rasse und/oder ihrer Kolonie usw.
Für alle Studien wurden die Bienen 10 bis 11 Tage lang mit durch Imidacloprid kontaminierten Sirup ernährt, der ad libitum verabreicht und täglich erneuert wurde. Die tatsächlich eingenommenen Mengen werden täglich durch Gewichts- oder Volumendifferenz ermittelt und auf einen Wert je Biene entsprechend der Anzahl der an dem betreffenden Tag lebenden Bienen zurückgeführt (außer bei den Studien von Wilhelmy – M225, M229- und Bruhnke M228, wo die Bewertung alle 2 Tage erfolgt und die eingenommene Sirupmenge entsprechend den Bienen ermittelt wird, die am ersten Testtag lebten). Die verzehrte Sirupmenge je Biene und Tag variiert während des Tests nicht signifikant und ist für Vergleichsbienen und die behandelten Bienen ähnlich. Die Käfige werden der gesamten Testdauer im Dunkeln gehalten, außer bei der Mortalitätsbestimmung.
Toxizitätsstudie für Imidacloprid
In den Studien des INRA in Avignon (M47) und Bures (so genannte „Sommerstudien“ M33), entsprechen die verwendeten Bienen, die Behandlungsmodalitäten sowie die Mortalitätsquote der Versuchsbienen nach 10 Tagen den von den CST-Mitgliedern etablierten Validierungskriterien. Zur Ermittlung signifikanter Mortalitätsdifferenzen zwischen den verschiedenen Dosen (ANOVA für Avignon und Khi-2-Test für INRA in Bures) wurde ebenfalls ein statistischer Test durchgeführt. Alter und Rasse der in den 2 Studien verwendeten Bienen waren unterschiedlich (Hybriden unterschiedlichen Alters (>20 Tage) für die Studien des INRA in Avignon und Apis mellifera ligustica von 3 Tagen für die Studien des INRA, Bures (M33 Sommerstudien). In der Studie von Avignon wurde die Sirupkonzentration nicht verifiziert, bei der Protokollerstellung wurden jedoch zahlreiche Vorsichtsmaßnahmen getroffen: Schutz des Sirups vor Licht, Kalkulationen des molaren Extinktionskoeffizienten, Expositionsbedingungen ähnlich den Umweltbedingungen (10 Std. Exposition gegenüber kontaminiertem Sirup, 14 Stunden gegenüber gesundem Sirup) usw. Bei der so genannten Sommerstudie von Bures wurde die Imidaclopridkonzentration im Gegensatz zu den so genannten Winterstudie nicht verifiziert. Die Winterdosierungen zeigten jedoch keine wesentlichen Verschlechterungsphänomene. Da das Zubereitungs- und Lagerungsprotokoll der 2 Studien identisch sind, betrachten die CST-Experten den in den so genannten Sommerstudien angegebenen Imidaclopridgehalt als validiert. Die Temperatur der Bienenhaltung von Bures liegt leicht über 30°C. Die CST-Experten gehen jedoch nicht davon aus, dass dieser Punkt allein einen Invalidierungsfaktor darstellt. Somit entsprechen diese 2 Studien den geltenden Validierungskriterien und validieren ihre Resultate. Die Studien von Avignon (M47) zeigen, dass man bei der schwächsten getesteten Sirupkonzentration (0,1 ppb) zu Beginn der 10 Tage 50 % Mortalität beobachtet, das heißt bei einer kumulierten eingenommenen Menge von 12 pg je Biene in10 Tagen. In den Sommerstudien von Bures-sur-Yvette im Jahr 2000 (M33) führte die schwächste Dosierung zu 20 % Mortalität, d.h. 32000 pg/Biene/10 Tage im Sommer (kumulierte Mengen: 32mg). Die Dosis ohne Auswirkungen beträgt 16 000 pg/Biene/10Tage. Es gibt jedoch einen Faktor 1000 zwischen der schwächsten in Avignon getesteten Dosis (50 % Mortalität) und der schwächsten Dosis, die bei den Sommerstudien in Bures-sur-Yvette (20 % Mortalität) Auswirkungen gezeigt hat. Dieser Faktor ist unter Berücksichtigung der kumulierten eingenommenen Dosis 3000. Im Gegensatz dazu wurden die anderen 3 Studien des INRA in Bures (M13, M33 „Winterstudie“, M257) aus folgenden Gründen nicht validiert:
– Die angenommene Ausgangslösung mit 100 ppb, die zur Herstellung aller Sirupe im Jahr 1998 (M13, M32) verwendet wurde, wurde von der GIRPA von Angers auf Antrag von Bayer analysiert. Die Analyse durch HPLC-UV hat eine tatsächliche Konzentration von fast 500 ppb gezeigt, welche die Autoren zu einer Berichtigung (M162) der zuerst veröffentlichten Daten (M13, M32) veranlasste. In diesem Sinn erscheint ein Faktor 5 wichtig, man muss jedoch wissen, dass die Technik von Angers Imidacloprid und alle seine Metaboliten misst und diese Analyse andererseits mehrere Monate nach den Tests durchgeführt wurde. Die Konservierungsbedingungen der Lösung können nicht garantieren, dass das Kosolvens nicht evaporiert ist. Dies in Verbindung mit den Protokollen, die zu dem Zeitpunkt erstellt wurden, hat die Autoren veranlasst, die Resultate von 1998 als nicht zuverlässig zu betrachten (persönliche Mitteilung von Herrn Decourtye). Diese Studie gilt somit als nicht validiert.
– Die Verifizierung der Imidaclopridkonzentration der getesteten Sirupe (definitive Lösungen) wurde für die in dem Bericht M33 beschriebenen Winterstudien durchgeführt (Pham-Delègue, 2000). Diese Analysen wurden dank einer Verknüpfung von HPCC und MS/MS bei dem CHU in Limoges mit der von dem CST validierten Dosiertechnik durchgeführt. Da diese Winterstudien jedoch bei geheiztem Bienenhaus erfolgten, diese Bienen nicht unter wirklichen Winterbedingungen lebten und auch nicht den wirklichen Sommerbienen entsprachen, sind diese Versuche für natürliche Umweltbedingungen nicht repräsentativ. Unter diesem Kriterium erklären wir diese Studie somit für ungültig. – Die Studie M257 entspricht somit nicht dem „klassischen“ Test auf chronische Toxizität. Diese Studie musste ein statistisches Modell der Mortalitätsdynamik bei der Hausbiene entwickeln, und zwar unter Berücksichtigung verschiedener Parameter, wie individuelle Geschichte jedes Individuums derselben Gruppe, Abhängigkeit der Bienen untereinander usw. Daher wurde diese Studie 60 Tage lang durchgeführt, was der Lebensdauer von Bienen unter Versuchsbedingungen entspricht. Darüber hinaus fehlen die unserer Problematik entsprechenden Daten, da am Ende der Studie nicht die Mortalitätsquote nach der 10-tägigen Exposition gegenüber Imidacloprid ermittelt wurde. Unter diesen sehr spezifischen Bedingungen können wir diese Studie nicht bewerten.
Toxizitätsstudie für die Metaboliten von Imidacloprid
Die chronische Toxizität (wiederholte Applikation) der Metaboliten von Imidacloprid (Hydroxy-Imidacloprid, Dihydroxy-Imidacloprid, Olefin, Guanidinderivat, 6-Chlornikotinsäure und Ureaderivat) wurde ebenfalls getestet. Während die Studien von Avignon sich auf alle oben genannten Derivate bezogen, hat das INRA in Bures nur 2 Verbindungen untersucht, die als die toxischsten gelten: Dihydroxy-Imidacloprid und Olefin. Die von der Firma Bayer in Auftrag gegebenen Laborberichte auf der Basis der Resultate von Suchail beziehen sich nur auf die Daten der subchronischen Toxizität von Ureaderivat und 6-Chlornikotinsäure.
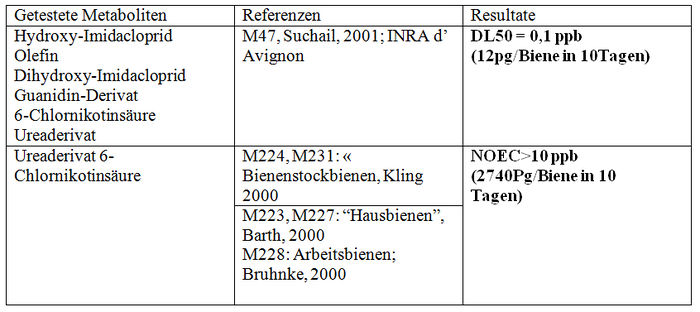
Die Studien des INRA in Avignon (Suchail, 2001, M47) und Bures (M33, M259, 2000, Decourtye) wurden zur gleichen Zeit durchgeführt wie die Imidacloprid-Studien und somit wurden die gleichen Protokolle verwendet (Anhang XXI). Aus den gleichen oben zitierten Gründen wird die Studie des INRA Avignon (Suchail, 2001, M47) validiert und die so genannte Winterstudie des INRA in Bures wird für ungültig erklärt. Die Studie von Avignon zeigt dieselben letalen Auswirkungen wie mit Imidacloprid (die gleichen getesteten Konzentrationen, die gleichen Mortalitätsquoten) mit den 6 Imidaclopridderivaten, ob sie sich in der akuten Toxizität als aktiv (5-Hydroxy-Imidacloprid, Olefin) erwiesen haben oder nicht (4,5–Hydroxy-Imidacloprid, 6-Chlornikotinsäure, Ureaderivate und Guanidin). Ein Dosiseffekt wurde mit Hydroxy-Imidacloprid demonstriert. Die Hälfte der Bienen sterben (DL50) ab 0,1 ppb der Metaboliten, was 1,2pg/Biene/Tag der Substanz entspricht.
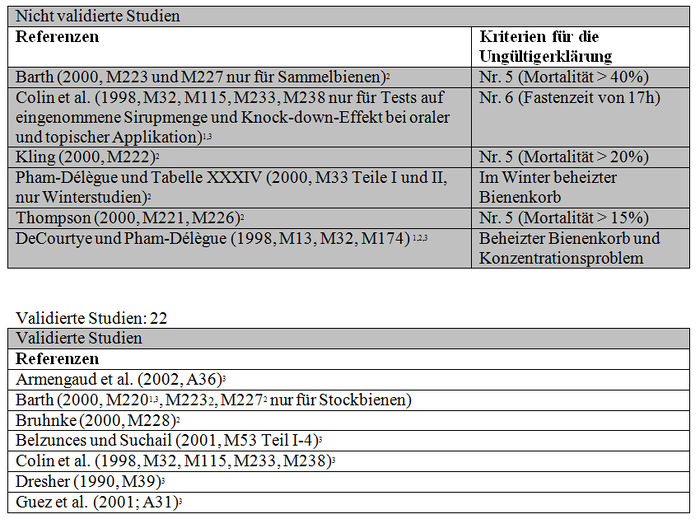
Mit Ausnahme der Studien von Thompson (2000, M221, M226) und Bruhnke (2000, M228) testen die von Bayer in Auftrag gegebenen Studien Ureaderivat und 6-Chlornikotinsäure bei 2 Bienenkategorien: die Sammelbienen und die Arbeitsbienen im Stock. Systematisch zeigen die Studien von Sammelbienen (Kling, M222, M230; Barth, M223, M227) eine sehr hohe Mortalität der Kontrollbienen (20 bis 45%). Sie können demzufolge gemäß den CST-Kriterien nicht validiert werden. Darüber hinaus werden die Studien von Wilhelmy unabhängig von dem Alter der Bienen (M225, M229) aufgrund der nicht zufälligen Verteilung der Bienen zu Beginn des Versuchs im Nachhinein von dem Autor für ungültig erklärt. In den Studien wird eine hohe Mortalität in den Gruppen beobachtet, die als letzte untersucht wurden und die ebenfalls höheren getesteten Dosierungen entsprechen. Es erscheint uns die Vorstellung schwierig, dass eine nicht zufällige Verteilung der Bienen allein für eine erhöhte Mortalität verantwortlich sein soll. Wir halten jedoch an dem Invalidierungskriterium fest, betonen aber, dass dies die einzigen Studien sind, die einen toxischen Effekt der Metaboliten zu zeigen scheinen. Die Studien von Thompson (M221, M226) verwenden Bienen unterschiedlichen Alters (2 bis 3 Wochen), aber selbst dann erreicht die Mortalitätsquote der Kontrollbienen am Ende der 10 Tage 50 %, unabhängig von dem getesteten Metabolit. Diese 2 Studien werden somit ebenfalls für ungültig erklärt.
Die Studien über die Stockbienen (Kling, M224, M231; Barth M223, M227; Bruhnke M228), zeigen am Ende der 10 Tage eine Mortalität der Kontollbienen von weniger als 15%. Sie entsprechen somit dem von CST festgelegten Validierungskriterium. Es wird jedoch angemerkt, dass in den Studien von Bruhnke die Feststellung der Mortalität und der Sirupwechsel nur alle zwei Tage erfolgt. Keine dieser validierten Studien zeigt signifikante Auswirkungen unter den Kontrollbienen und den Versuchsbienen, unabhängig von der Dosis der eingenommenen Metaboliten. Obwohl sich bei den getesteten Dosen kein toxischer Effekt gezeigt hat, gestatten die von Bayer in Auftrag gegebenen Studien nur den Schluss auf einen validierten NOEC-Wert von über 10 ppb.
d) Kommentare und Perspektiven
Obwohl in zahlreichen Arbeiten versucht wurde, einen toxischen oder nicht toxischen Effekt von Imidacloprid (7 Studien) und seinen Metaboliten (13) nachzuweisen, erhalten wir nur sehr partielle Resultate und es konnten nur einige Resultate validiert werden. Darüber hinaus wurde in den Daten zur chronischen Toxizität (infolge wiederholter Applikationen aktiver Substanzen) eine große Diskrepanz beobachtet, die sich unter anderem durch Differenzen der Protokolle erklären, die in den Anhängen XX und XXI synthetisiert sind.
Unter ihnen zitieren wir unter anderem: • Das Alter der Bienen: bei den Studien von Kling und INRA in Bures wurden Bienen verwendet, die nach ihrem Ausschlüpfen als Versuchsbienen genommen wurden und deren Alter somit bekannt und homogen war. Bei den Studien des INRA in Avignon und bestimmter von Bayer beauftragter Labors (siehe Anhang XXI) werden eher junge aber verschieden alte Bienen verwendet, die aus den Rahmen genommen wurden, bei anderen von Bayer in Auftrag gegebenen Studien werden ebenso Bienen verwendet, die bei dem Eintritt in den Bienenkorb genommen wurden und von denen man annimmt, dass es sich um Sammelbienen im Alter von mehr als 3 Wochen handelt. In diesem Zusammenhang merken wir an, dass die Studien mit Sammelbienen unter den Kontrollbienen eine hohe Mortalitätsquote aufweisen. Sie sind demnach nicht zu empfehlen. Darüber hinaus hängt das Alter der Bienen von der nachzuweisenden Auswirkung ab. Wenn man eine allgemeine Auswirkung eines Pestizids auf die Kolonie nachweisen möchte, ist es besser, Bienen unterschiedlichen Alters zu nehmen, für die Studie einer Auswirkung auf eine bestimmte Bienenart erscheint die Entscheidung, die Probenahmen nach ihrem Ausschlüpfen durchzuführen, sinnvoller. • Die Bienenrasse: das INRA in Bures hat Bienen der Rasse ligustica ausgewählt, das INRA in Avignon hat mit einem Mischling gearbeitet, während die von Bayer beauftragten Labors Apis mellifera carnica ausgewählt haben. • Die Anästhesie: die Verwendung von Bienen, die dem Rahmen entnommen werden, benötigen häufig eine Anästhesie, was bei den Bienen, die beim Ausschlüpfen entnommen werden, nicht der Fall ist. Somit betäubt INRA in Avignon ebenso wie Thompson die Bienen,. Es ist anzumerken, dass die Kontrollbienen bei diesem Autor eine hohe Mortalitätsquote aufweisen. Dies wirft die Frage nach einer Bienensensibilisierung während der Anästhesie auf, obwohl die Resultate des INRA in Avignon diese Hypothese nicht unterstützen. Während seiner Anhörung durch das CST unterstreicht Herr Belzunces jedoch die Notwendigkeit einer kurzen Anästhesie. • Die Verwendung eines Kosolvens: bei keiner der von Bayer in Auftrag gegebenen Studien wird ein Kosolvens zur Auflösung von Imidacloprid (Wasserlöslichkeit 0,58g/l) verwendet. INRA Avignon verwendet 1 % DMSO und INRA Bures 1 % Azeton (M33, M259). • Die Mortalitätsberechnung: bei den Studien der INRA in Avignon und Barth wird, anders, als bei anderen Studien, die Korrektur von Abott verwendet. • Wenn diese Protokolldifferenzen die Diskrepanz der erhaltenen Resultate erklären können, wird man jedoch betonen, dass in der Welt der Bienen eine wesentliche Variabilität üblich ist
Hinsichtlich der Studien zur chronischen Toxizität von Imidacloprid wurden nur zwei Studien (M47, Suchail und M33 Sommerstudien, Decourtye) validiert. Aus der Studie von INRA Avignon ergibt sich ein DL50-Wert von 12 pg/Biene/10Tage, aus der von INRA in Bures ein NOEC-Wert von16 000/Biene/10Tage und ein LOEC-Wert von 31 680 pg/Biene/10Tage.
In Bezug auf die validierten Tests (6) auf chronische Toxizität der Metaboliten von Imidacloprid zeigen die Studien von Avignon (Suchail, 2001, M47) die gleichen letalen Auswirkungen wie die Studien mit Imidacloprid (die gleichen getesteten Konzentrationen, die gleichen letalen Auswirkungen) mit 6 Imidacloprid-Derivaten, ob sie sich in der akuten Toxizität als aktiv (5-Hydroxy-Imidacloprid, Olefin) erwiesen haben oder nicht (4,5–Hydroxy-Imidacloprid, 6-Chlornikotinsäure, Ureaderivate und Guanidin). Bei einer täglichen Einnahme je Biene von 1,2 pg Imidacloprid oder seinen Derivate während 10 Tagen ergibt sich eine Mortalität von 50 %. Der Autor erklärt diese Resultate durch Interaktion des 6-Chlornikotinyl-Teile mit einem angenommenen spezifischen Rezeptor, was die Firma Bayer dazu veranlasst hat, bei den oben erwähnten vier Labors ergänzende Studien mit dem Ureaderivat und 6-Chlornikotinsäure durchzuführen.. Man stellt fest, dass diese 2 Metaboliten nicht diejenigen sind, für die Suchail (2000, M47) und Decourtye (2000, M191) jeweils akute Toxizitätseffekte (1 einzige Applikation) und chronische Toxizitätseffekte (wiederholte Applikation) nachgewiesen haben. Es wird betont, dass diese Firma in Anbetracht der bereits existierenden Resultate von DeCourtye (M33) keine Studien zur chronischen Toxizität von Imidacloprid durchgeführt hat, sondern diejenigen von Suchail verifiziert hat. Die einzige Studie eines von Bayer beauftragten Labors, die eine über 50 %-ige Mortalität der Bienen bei Konzentration von 0,1 ppb Ureaderivat und 6-Chlornikotinsäure nachgewiesen hat, wurde von den Autoren wegen der nicht zufälligen Verteilung der Bienen für ungültig erklärt. Einige dieser von Bayer in Auftrag gegebenen Studien wurden von dem CST validiert und belegen keine signifikanten Auswirkungen von Ureaderivat und 6-Chlornikotinsäure auf die Bienenmortalität durch chronische Toxizität. Sie gestatten nur den Schluss auf einen NOEC-Wert von mehr als 10 ppb für diese Metaboliten. Man stellt sich jedoch die Frage nach der Auswahl der verwendeten statistischen Tests (in den meisten Fällen Tests von Student), die zwangsläufig nicht unter einem analytischen Aspekt validiert wurden und die die Wiederholung der Intoxikation im Zeitverlauf nicht berücksichtigen.
Als Schlussfolgerung beruhen die gültigen Resultate, über die wir hinsichtlich der Toxizität infolge wiederholter Applikation von Imidacloprid und seinen Metaboliten verfügen, die die Auswirkungen bei akuter Toxizität (Hydroxy-Imidacloprid und Olefin) zeigen, auf zwei Studien beziehungsweise einer Studie, was uns für eine Schlussfolgerung als unzureichend erscheint. Darüber hinaus merken wir an, dass unseres Wissen keine Studie über die Bewertung der Mortalität infolge chronischer Intoxikation durch topische Applikation existiert. Das CST erachtet es als notwendig, zusätzliche Versuche unter Anwendung eines standardisierten Protokolls durchzuführen und dabei präzise Fragen zur Definition der Studienbedingungen (Intoxikation der jungen Bienen, die im Bienenkorb bleiben durch Pollen oder Intoxikation der Sammelbienen, die den Bienenkorb verlassen durch Nektar) zu beantworten.
Subletale Auswirkungen von Imidacloprid und seinen Derivaten auf Bienen
Bei den meisten der nachfolgend präsentierten Studien wurden kleine Bienengruppen oder -kolonien verwendet. Die Protokolle nehmen Bezug auf die in den Sirupen enthaltenen Imidaclopridkonzentrationen, ohne immer die aufgenommene Menge des Sirups je Biene zu präzisieren. Um die LOEC-Werte (Lowest Observed Effect Concentration) und NOEC-Werte (No Observed Effect Concentration) der subletalen Auswirkungen mit den DL50-Werten vergleichen zu können, die in Imidaclopridgewicht je Biene ausgedrückt werden, wird die je Biene getestete Imidaclopridmenge bekannt gegeben. In einigen Fällen sind die je Biene applizierten Imidaclopridmengen bekannt, das heißt, die Autoren der Studien haben sie zuvor ermittelt (in den Ergebnistabellen mit den Werten werden sie mit (1) hinter dem Wert gekennzeichnet), aber in den meisten Fällen sind sie unbekannt. Bei diesen letzten Studien sahen wir uns veranlasst, die pro Biene applizierten Imidaclopridmengen selbst zu schätzen, ausgehend von den bekannten Durchschnittsmengen verzehrten Nektars je Biene und Tag (in den Ergebnistabellen mit den Werten werden sie mit (2) hinter dem Wert gekennzeichnet). Sie betragen 25 bis 70 mg je Sammelbiene (Belzunces und Taséi 1997, M46; Winston 1987 A85).
Wir verfügen über keine offizielle Direktive für die Bewertungen von Studien über subletale Auswirkungen. Demzufolge haben wir die Bewertungskriterien ausgewählt, die teilweise denjenigen entsprechen, die von der OEPP (2001) (Organisation Européenne für la Protection des Plantes) vorgeschlagen wurden. Die OEPP veröffentlicht die Direktiven veröffentlicht, die die Arbeitsgruppe «Bee Protection» der internationalen Kommission ICPBR (International Commission for Plant Bee Relationships) vorschlägt. In diesen Direktiven werden Bewertungsmethoden in Bezug auf die Toxizität und Gefährlichkeit von Insektiziden für Bienen vorgeschlagen (Labortests zur Bestimmung des DL50-Werts je Kontakt und Einnahme sowie Tests, die in Flugkäfigen, in Tunneln und im Freiland durchgeführt werden.
Die nachfolgend dargestellten Resultate stammen aus Tests, bei denen die subletalen Auswirkungen von Imidacloprid und seinen Metaboliten auf Bienen nach einer (akut) oder mehreren oralen oder topischen Applikationen (chronisch) im Labor beobachtet und gemessen wurden (Tabellen XXIV bis Tabelle XXVIII), im Flugkäfig (Tabelle XXX), in Tunneln (Tabellen XXXI bis Tabelle XXXIV) und im Freiland (Tabellen XXXVI bis Tabelle XXXIX). Wenn alle getesteten Konzentrationen zu einer Auswirkung führen oder, im Gegenteil, wenn keine getestete Konzentration zu einer Auswirkung führt, ist dies durch das Zeichen „-“ in der entsprechenden Spalte gekennzeichnet. Diese Analysen wurden auf die Bewertung verschiedener Verhaltensweisen angewendet: motorische Koordination, Mobilität, Lernfähigkeit, Erinnerungsvermögen, Orientierungsvermögen, Sammelvermögen, Tänze, Gelege, Sammeln von Pollen und Nektar, und Honig- und Wachsproduktion.
Laborstudien
Resultate disponibles
Liste der Studien
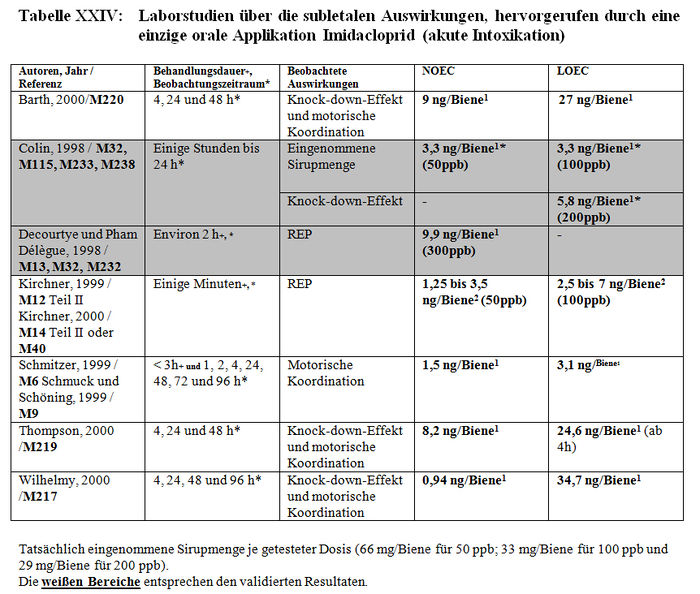
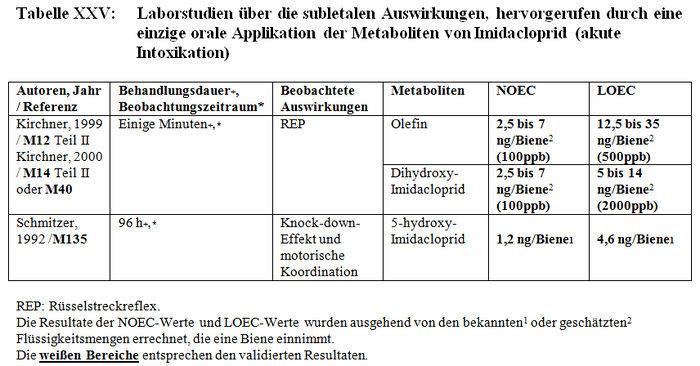
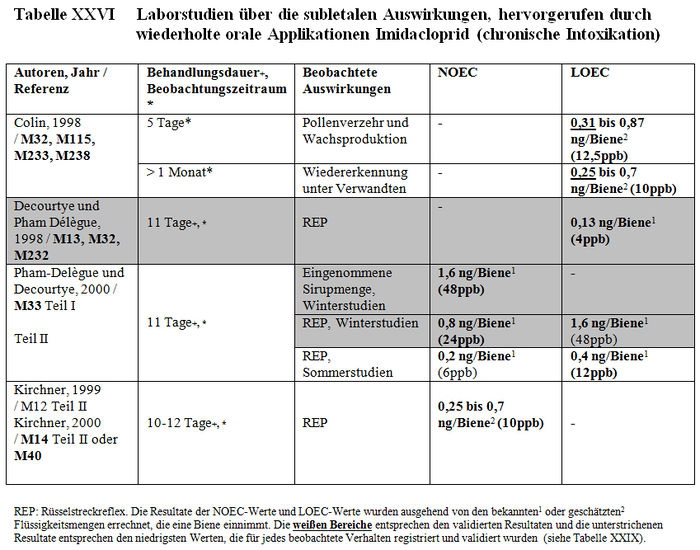
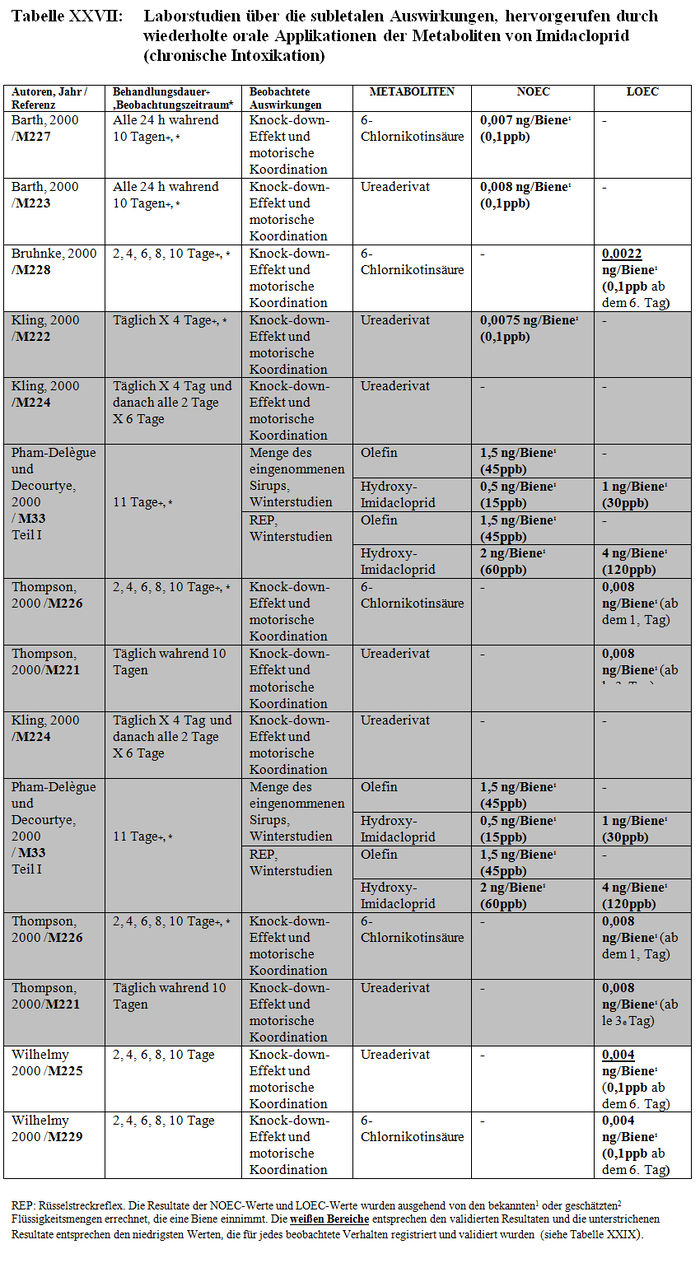
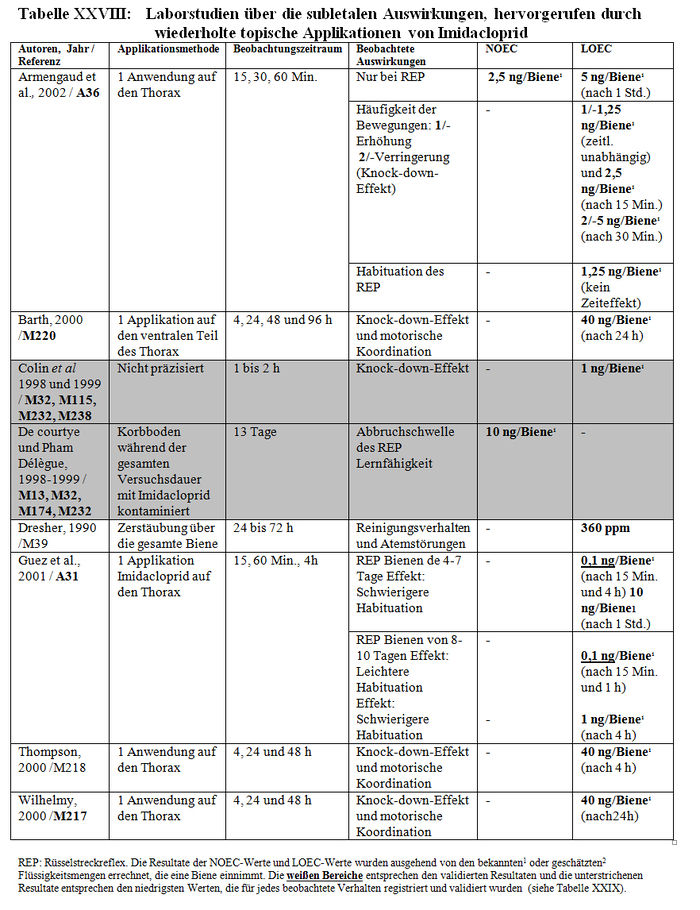
Die Analyse der subletalen Auswirkungen im Labor umfasst 33 Studien: – 8 Studien beziehen sich auf die verhaltensspezifischen Auswirkungen, die nach einer akuten oralen Intoxikation durch Imidacloprid beobachtet wurden (Barth 2000, M220; Colin 1998, M32, M115, M233, M238; Decourtye und Pham-Délègue 1998, M13, M32, M232; Kirchner 1999, M12, M14, M40; Schmitzer 1999, M6; Schmuck und Schöning 1999, M9; Thompson 2000, M219; Wilhelmy 2000, M217) (sieheTabelle XXIV); – 2 Studien beziehen sich auf die verhaltensspezifischen Auswirkungen, die nach einer akuten oralen Intoxikation durch die Metaboliten von Imidacloprid beobachtet wurden (Kirchner 1999, M12, M14, M40; Schmitzer 1992, M134) (siehe Tabelle XXV); – 4 Studien beziehen sich auf die verhaltensspezifischen Auswirkungen, die nach einer chronischen Intoxikation durch Imidacloprid beobachtet wurden (Colin 1998, M32, M115, M233, M238; Decourtye und Pham-Delègue 1998, M13, M32, M232; Pham-Délègue und Decourtye 2000, M33; Kirchner 1999, M12, M14, M40) (siehe Tabelle XXVI); – 10 Studien beziehen sich auf die verhaltensspezifischen Auswirkungen, die nach einer chronischen Intoxikation durch die Metaboliten von Imidacloprid beobachtet wurden (Barth 2000, M223 und M227; Bruhnke 2000, M228; Kling 2000, M222 und M224; Pham-Delègue und Decourtye 2000, M33; Thompson 2000, M221 und M226; Wilhelmy 2000, M225 und M229) (siehe Tabelle XXVII); – 9 Studien beziehen sich auf die verhaltensspezifischen Auswirkungen, die nach einer topischen Applikation von Imidacloprid beobachtet wurden (Armengaud et al. 2002, A36; Barth 2000, M220; Belzunces und phasisch 2001, M53 Teil 4; Colin et al. 1998 und 1999, M32, M115, M232, M238; Decourtye und Pham-Délègue 1998, M13, M32, M232; Dresher 1990, M32; Guez et al. 2001, A31; Thompson 2000, M218; Wilhelmy 2000, M217) (siehe Tabelle XXVIII).
Gemessene Auswirkungen:
– Der «Knock-down-Effekt». Er wird definiert als vollkommene Paralyse und scheinbarer Tod des Individuums, der sich durch den wirklichen Tod nur durch seine Reversibilität unterscheidet (Colin et al. 1998, M32, M232, M233, M238; 1999, M115). – Die motorische Koordination. Sie kann durch Zittern des Körpers gefolgt von Apathie gestört sein. – REP, Rüsselstreckreflex. Er ermöglicht die Auswertung des olfaktorischen Erinnerungs- und Lernvermögens nach einer Konditionierung. – Die Nahrungsaufnahme wird als von den Bienen aufgenommene Pollen- oder Sirupmenge gemessen. Es ist angebracht, einen Unterschied zu machen zwischen der Menge, die von der Biene aufgenommen und tatsächlich eingenommen wird. Die von einer Biene aufgenommene Sirupmenge wird nicht automatisch von ihr eingenommen, da sie sie mehrere Stunden in ihrem Kropf speichern und in der Kolonie ausbrechen kann (Trophallaxis, Speicherung in den Waben usw.). Demzufolge messen die Kurzzeitstudien eher die von der Biene aufgenommenen anstatt die von ihn eingenommenen Mengen, während die Langzeitstudien die Schätzung der von der Biene tatsächlich absorbierten Mengen gestattet. – Das Erkennungsvermögen zwischen Bienen vom gleichen Stamm oder Verwandten. – Die Wachsproduktion
Die Resultate
b) Validierungskriterien
Zu den Bewertungskriterien, die wir als Grundlage für unsere Bewertung der Laborstudien über subletale Auswirkungen ausgewählt haben, gehören zum Teil diejenigen, die von der OEPP (2001) (Organisation Européenne für la Protection des Plantes) vorgeschlagen wurden, und zwar die folgenden:
• Nr. 1: Imidacloprid oder seine Metaboliten müssen vor Licht geschützt oder häufig (maximal alle 2 Stunden) ausgetauscht werden, um eine Photodegradation zu vermeiden, die eine Verzerrung der Toxizitätsstudie des getesteten Produktes zur Folge hätte.
• Nr. 2: Die auf die Bienen oral oder topisch applizierten Imidaclopridmengen werden in der Studie gemessen und werden, falls dies nicht geschieht, durch die Errechnung des Tagesdurchschnitts des je Biene verzehrten Nektars geschätzt.
• Nr. 3: Die Bienen müssen in einem guten physiologischen Zustand sein.
• Nr. 4: Häufigkeit und Dauer der Behandlung sind präzisiert.
• Nr. 5: Ein Minimum von 30 Bienen, je Behandlung, aufgeteilt in 3 separierte Lose (3 Körbe à 10 Bienen), ist notwendig, und die Mortalität des Kontrollloses muss < 10 % betragen.
• Nr. 6: Der vorherige Fastenzeitraum muss zwischen 2 und 4 Std. betragen.
Die Bienen können aus derselben Kolonie stammen oder nicht und gleichaltrig sein oder nicht. Bei Bienen aus verschiedenen Kolonien oder unterschiedlichen Alters kann eine höhere Variabilität beobachtet werden.
c) Validierte Resultate
Die Resultate der Bewertung der Laborstudien über die subletalen Auswirkungen werden in Tabelle XXIX synthetisiert. 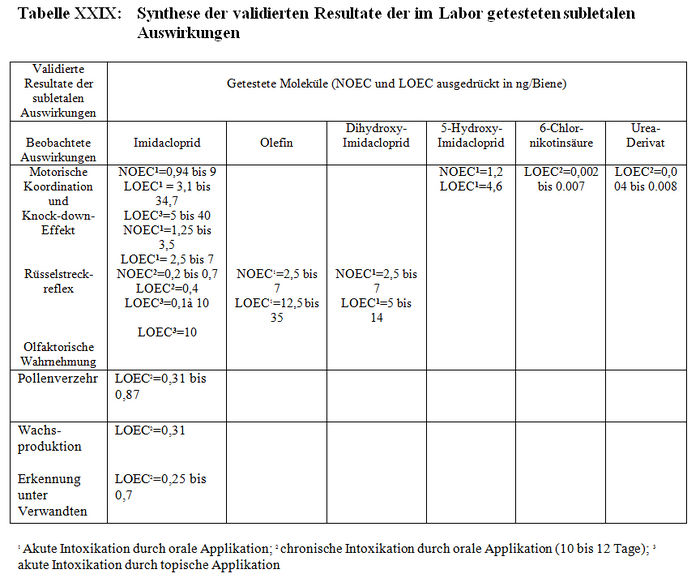
Die Studien, die die in Absatz 4.2.1 (Teil b) zitierten Validierungskriterien erfüllen, konnten validiert werden und im Gegensatz dazu konnten die Studien, die diese Validierungskriterien nicht erfüllen, aus den im Folgenden präzisierten Gründen nicht validiert werden: – Barth (M223, M227 und Thompson (M221, M226). Die Mortalitätsquote der Kontrollbienen liegt über 10 %. – Colin et al. (1998, 1999; M32, M233, M238, M115). Die vorherige Fastenzeit der Bienen beträgt mehr als (17 h) 4 Std. – Kling (2000, M222; M224). In der ersten Studie (M222) liegt die Mortalitätsquote der Bienen in dem Kontrolllos (20 %) über 10 %. In der zweiten Studie (M224) werden keine Daten angegeben. Mangels dieser Resultate kann die Studie nicht Gegenstand einer Bewertung sein. – Pham-Délègue (2000, M33, Teile I und II). Die Winterbienen stammen aus beheizten Kolonien. Diese Testbedingungen entsprechen nicht den natürlichen Bedingungen, denen die Winterbienen ausgesetzt sein können. Aus den gleichen Gründen werden die Studien M13, M32 und M232 für die Tests auf kurzfristige subletale Auswirkungen im Fall von akuten oralen Intoxikationen für ungültig erklärt.
d) Kommentare und Perspektiven
Die Variabilität der zuvor analysierten Studienresultate kann auf die Verwendung unterschiedlicher Protokolle zurückzuführen sein. Die verwendeten unterschiedlichen Protokolle sind in Anhang XXII synthetisiert; die von den Autoren erbetenen Informationen und die entsprechenden Antworten sind in den Anhängen XVIII und XIX aufgeführt. Von einer Studie zur anderen und innerhalb ein und derselben Studie können die folgenden Parameter eine Ursache für Schwankungen darstellen. – Rasse der getesteten Bienen (A. mellifera ligustica, carnica, mellifera, caucasica, Mischlinge und synthetische Nachkommenschaft Buckfast). – Alter und Kategorie der (Bienen unbekannten Alters oder eines bestimmten Alters (4 – 42 Tage), Sommer- oder Winterbienen, Ammenbienen oder Sammelbienen) – Heterogenitätsgrad der verwendeten Kolonien. – Aufzuchtbedingungen (beheizter Bienenkorb oder nicht) – Menge des eingenommenen kontaminierten Sirups (von 10 µl bis 33 µl / Biene / Tag oder von 18 bis 82 mg / Biene / Tag) und des auf den Thorax der Biene aufgetragenen aktiven Materials (von 1µl bis 5 µl / Biene). – Motivation der Bienen zum Nahrungskonsum (entsprechend dem Fastenzeitraum (von 1 bis 17 h) und der Zuckerkonzentration der kontaminierten Sirupe (20 % oder 50 %). – Erheblichkeit der Beobachtungen (entsprechend ihrer Dauer und Häufigkeit. Für die bei Kurzzeitstudien analysierten Effekte wurden die Beobachtungen im Allgemeinen 15, 30, 60 und 240 Minuten nach dem Kontakt oder der Einnahme von Imidacloprid gemacht. Für die bei Langzeitstudien analysierten Effekte wurden einige Beobachtungen 24, 48, 72, 96 Stunden oder 11 Tage nach der Imidacloprid-Applikation gemacht und andere während 2 bis 13 Tagen der Imidacloprid-Applikation alle 24 Std.
Es erscheint notwendig, neue offizielle Direktiven einzusetzen, die für die Studie der subletalen Auswirkungen phytosanitärer Produkte auf Bienen standardisierte Protokolle verwenden, um unterschiedliche Protokolle zu vermeiden, die den Vergleich von Studien erschweren.
In Tunneln und Flugkäfigen durchgeführte Studien
a) Verfügbare Resultate
Liste der Studien
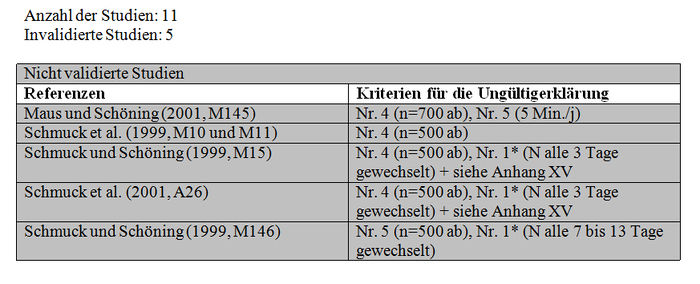
Insgesamt bezieht sich die Analyse der subletalen Auswirkungen in Tunneln auf 11 Studien: – 1 im Flugkäfig durchgeführte Studie (Kirchner 1999 und 2000; M12 Teil II, M14 Teil II oder M40) (siehe Tabelle XXX). – 4 Studien mit durch Imidacloprid und seine Metaboliten kontaminierten Sirup, der sich in den Futterplätzen befand (Colin et al. 1998, M115, M238; Colin und Bonmatin 2000, M3, M114, M193; Les und Pham-Delègue 1998 und 1999, M32, M174, M233) (siehe Tabelle XXXI und Tabelle XXXII). – 3 mit kontaminierten Pollen und Honig durchgeführte Studien (Maus und Schöning 2001, M145; Schmuck und Schöning 1999, M15 und M146; Schmuck et al. 1999, M10, M11; 2001, A26) (siehe Tabelle XXXIII). – 3 Studien über mit Gaucho behandelte Sonnenblumenkulturen (Ambolet et al. 1997, M158; Schmuck et al. 1999, M10, M11; Tisseur 1998 und 1999, M32, M179, M232). (siehe Tabelle XXV).
Beobachtete Auswirkungen
Außer für die oben beschriebenen Verhaltensweisen (siehe Absatz 4.2.1) haben sich die Autoren der Tunnelstudien auch für Beobachtungen des Verhaltens beim Honigsammeln (Frequentierung der Futterplätze und Rückkehr zum Bienenkorb) und des Verhaltens beim Wiedererkennen eines Geruchs interessiert
Resultate
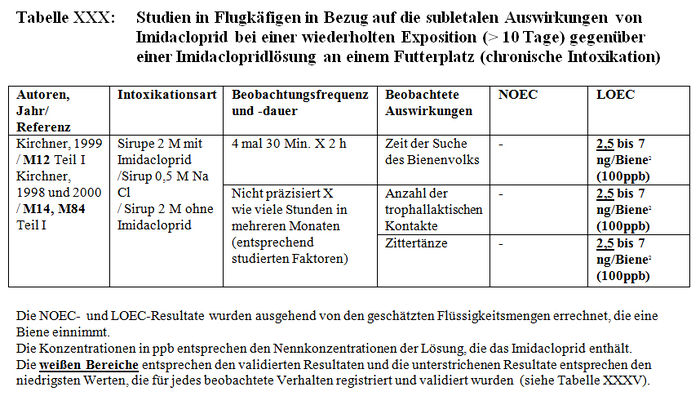
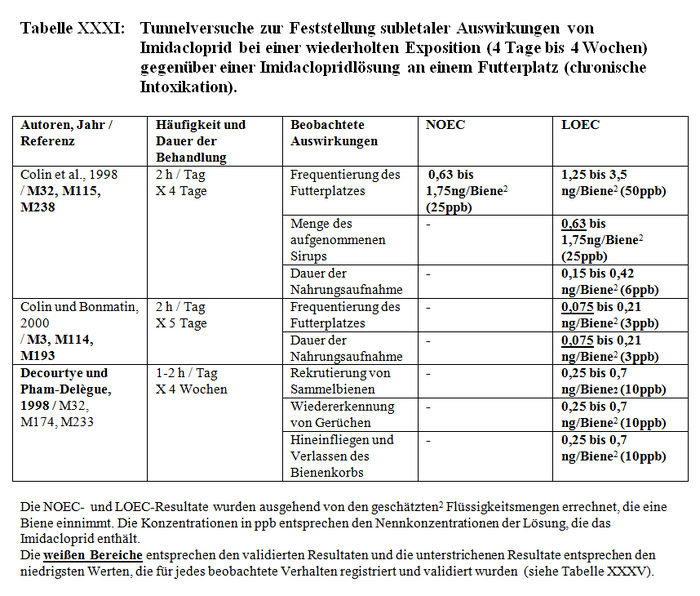
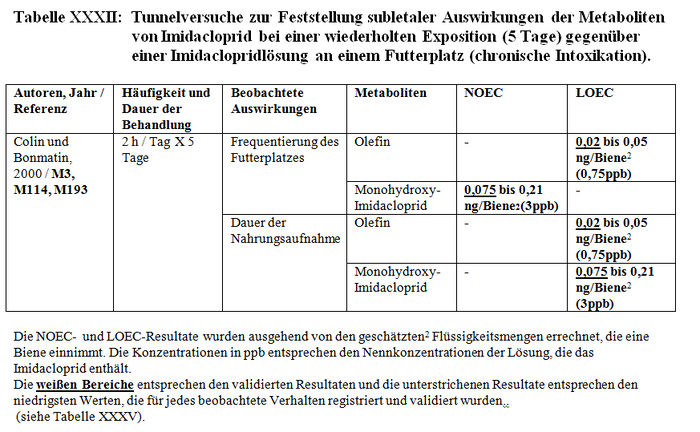
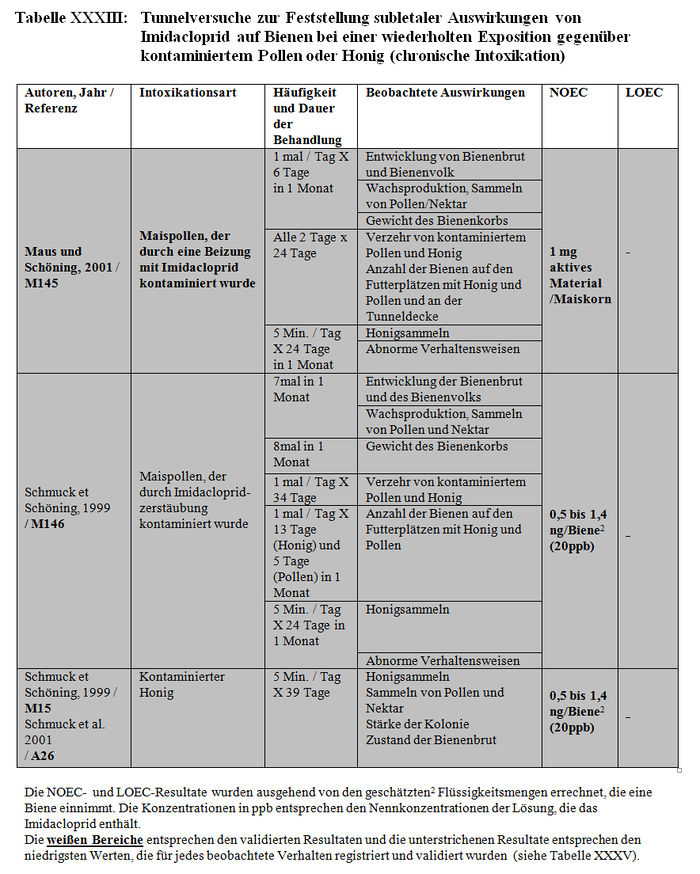
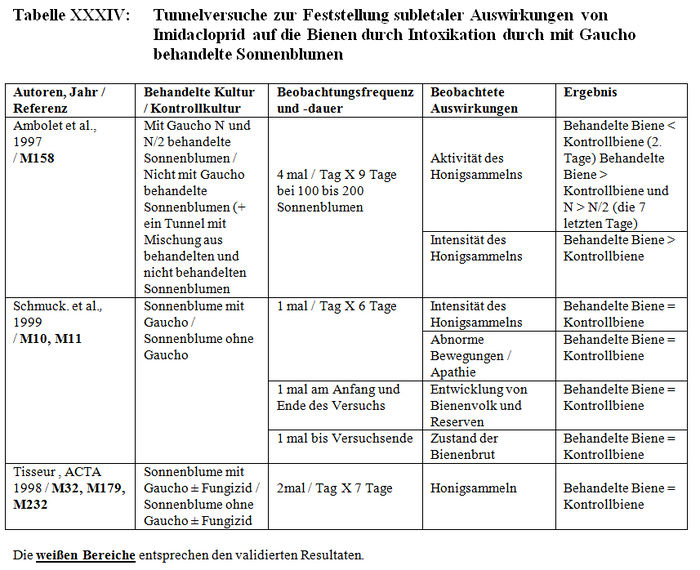
Die Versuchsresultate der Feststellung der subletalen Auswirkungen in Tunneln belegen entweder signifikante Differenzen zwischen den Losen der behandelten Bienen und den Losen der Kontrollbienen oder keine Verhaltensdifferenzen. Die Studien, in denen signifikante Differenzen der Verhaltensweisen nachgewiesen wurden, haben gezeigt: – Eine Verringerung von ca. 15 Bienen bis auf weniger als 3 Bienen am Futterplatz nach einer Stunde Honigsammeln, das heißt ein Nachlassen der Frequentierung der Futterplätze, wenn diese kontaminierten Sirup enthielten. (Colin et al. 1998, M32, M115, M238). – Eine Verringerung der Menge des aufgenommenen Sirups und der Dauer der Nahrungsaufnahme der Bienen, die kontaminierten Sirup verzehren (Colin et al. 1998, M32, M115, M238). – Eine Verringerung der Aktivität des Honigsammelns zwischen dem 1. und 2. Beobachtungstag (Ambolet et al. 1997, M158) und ab dem 2. Tag auf behandelten Kulturen. – Eine Verringerung der Rekrutierung bei den behandelten Bienenlosen (Decourtye und Pham Délègue 1998, M32, M174, M233). – Eine Beeinträchtigung des Wiedererkennungsvermögens von Gerüchen bei behandelten Bienenlosen (Decourtye und Pham Délègue 1998, M32, M174, M233). – Eine Vermehrung der Zittertänze und der Anzahl der trophallaktischen Kontakte in den behandelten Bienenlosen (Kirchner 1999 und 2000; M12 Teil II, M14 Teil II oder M40).
b) Die Validierungskriterien
Zusätzlich zu dem Validierungskriterium Nr. 1 für die Bewertung der durchgeführten Laborstudien haben wir folgende Kriterien festgestellt: • Nr. 1 (Schutz von Imidacloprid, siehe Laborstudien) • Nr. 2: Die Flugkäfige müssen groß sein, d.h. mindestens 2 x 2 x 3 m und die Tunnel müssen 7 bis 8 m breit, 17 bis 20 m lang und 3 bis 3,5 m hoch sein. • Nr. 3: Die Versuchsbienenkörbe müssen homogen sein und eine ausreichende Entwicklung aufweisen (mindestens 3 Rahmen mit Bienenbrut) • Nr. 4: Die Studien, die sich für Parameter in Verbindung mit der Kolonie interessieren (Aktivität, Entwicklung, Bienenbrut, Sammeln von Honig, Nektar und Pollen, Wachsproduktion etc.) müssen Kolonien von mindestes 4000 Bienen umfassen, da eine Kolonie unter natürlichen und normalen Bedingungen aus ca. 40 000 Bienen besteht. • Nr. 5: Die Verhaltensstudien müssen mehrere Beobachtungsreihen von signifikanter Dauer umfassen.
c) Validierte Resultate
Die Bewertungsresultate zu den Studien über die subletalen Auswirkungen bei den Tunneltests sind in Tabelle XXXV synthetisiert. Die von den Autoren erbetenen entsprechenden Protokolle und Zusatzinformationen werden in den Anhängen XXIII, XIX beziehungsweise XX dargestellt.
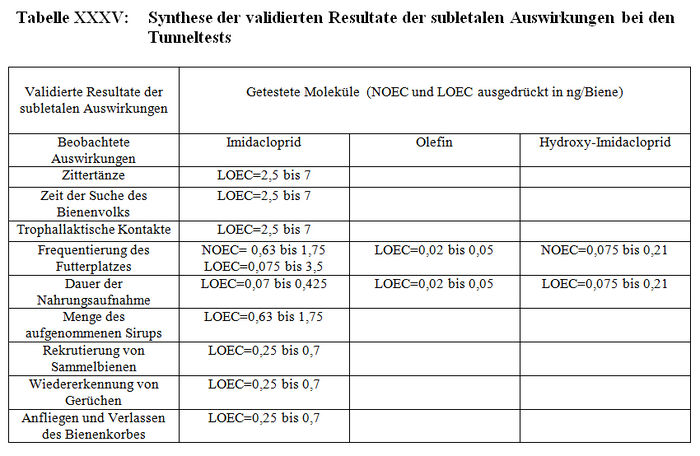
Die Studien, die die in Absatz 3.2.1 (Teil b) zitierten Validierungskriterien erfüllen, konnten validiert werden und im Gegensatz dazu konnten die Studien, die diese Validierungskriterien nicht erfüllen, aus den im Folgenden präzisierten Gründen nicht validiert werden:
– Maus und Schöning (2001). Die Mikrokolonien bestehen aus einer Anzahl von weniger als einigen Tausend Bienen (n = 700 Bienen / Kolonie). Das Verhalten der Bienen wurde nur 5 Minuten pro Tag beobachtet. – Schmuck et al. (1999, M10 und M11). Die Mikrokolonien bestehen aus einer Anzahl von weniger als einigen Tausend Bienen (n = 500 Bienen / Kolonie). – Schmuck und Schöning (1999, M15) und Schmuck et al. (2001, A26). Diese Studien waren Gegenstand der in Anhang XXV beschriebenen umfassenden Bewertungsanalyse. Außerdem besteht keine Eindeutigkeit darüber, wie die Futterplätze vor Licht geschützt sind (geschützter Behälter bedeutet nicht, dass die Futterplätze amberfarben sind). Da die Futterbehälter nur alle 3 Tage ausgewechselt werden, besteht, wenn sie nicht sachgemäß gegen Licht geschützt sind, das Risiko der Photodegradation von Imidacloprid. Die beobachteten Auswirkungen sind somit auf die Metaboliten zurückzuführen, die toxisch oder nicht toxisch sein können. – Schmuck und Schöning (1999, M146) Die Mikrokolonien bestehen aus einer Anzahl von weniger als einigen Tausend Bienen (n = 500 Bienen / Kolonie). Außerdem besteht keine Eindeutigkeit darüber, wie die Futterplätze vor Licht geschützt sind (siehe oben). Da die Futterplätze nur alle 7 -13 Tage gewechselt werden, besteht, wenn sie nicht sachgemäß gegen Licht geschützt sind, das Risiko der Photodegradation von Imidacloprid.
d) Kommentare und Perspektiven
Die Studien in Tunneln und auf Kulturen stellen interessante Möglichkeiten zur Analyse der Auswirkungen behandelter Kulturen auf die Aktivität des Honigsammelns dar. Die Aktivität des Honigsammelns dürfte sich nicht auf ein Zählen der Bienen je Blüte beschränken (was zu zahlreichen Verzerrungen führen kann), sondern auf eine Fein- und Qualitätsanalyse des individuellen Verhaltens jeder Biene, die auf verschiedenen Blüten sammelt. Darüber hinaus wird bei den Tunnelversuchen nicht zwischen den Bienen unterschieden, die den Sirup verzehren und den Bienen, die nur partiell oder überhaupt nicht verzehren und die nur den Transport in ihrem Kropf durchführen, insbesondere, wenn die an dem Futterplatz anwesenden Bienen nicht identifiziert und markiert werden. Für derartige Studien können die beobachteten Antworten je nach dem Verzehrniveau des Sirups von den Bienen somit sehr unterschiedlich sein. Ebenso werfen die Studien, die kontaminierten Sirup, Pollen und Honig verwenden, das für diese Nahrungsmittelarten vorhandene Problem der eventuellen Imidacloprid-Degradation im Laufe der Zeit durch Licht auf, insbesondere, wenn das Futter an den Futterplätzen nicht häufige erneuert wird. Die Imidacloprid-Dosierung in diesen Nahrungsmitteln müsste vor und nach dem Versuch realisiert werden.
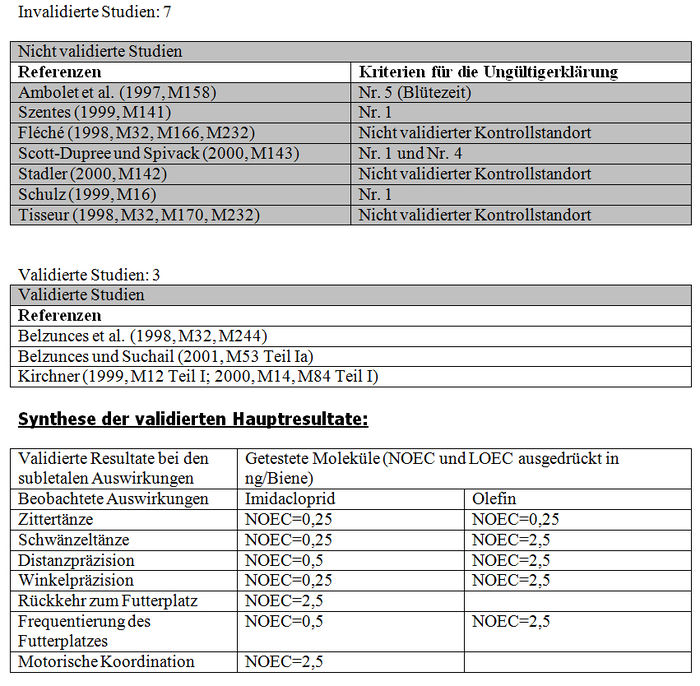
Freilandstudien:
a) Verfügbare Resultate
Liste der Studien:
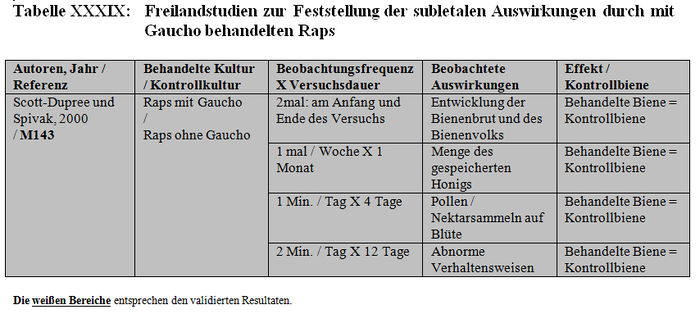
Die Analyse der subletalen Auswirkungen im Freiland bezieht sich auf 11 Studien: – 4 Studien, die mit kontaminiertem Sirup durchgeführt wurden, der in den Futterbehältern enthalten war (Belzunces et al. 1998, M32, M244; Belzunces und Suchail 2001, M53 Teil I a; Kirchner 1999, M12; 2000 M14, M84 Teil I) (siehe Tabelle XXXVI und Tabelle XXXVII). – 6 Studien mit Sonnenblumenkulturen, die mit Gaucho behandelt worden waren (Ambolet et al. 1997, M158; Fléché 1998, M32, M166, M232; Schulz 1999, M16; Stadler 2000, M142; Szentes 1999, M141; Tisseur 1998, M32, M170, M232) (siehe Tabelle XXXVIII) – 1 Studie mit Rapskulturen, die mit Gaucho behandelt worden waren (Scott-Dupree und Spivack 2000, M143) (siehe Tabelle XXXIX).
Beobachtete Auswirkungen:
Zusätzlich zu den oben beschriebenen Verhaltensweisen (siehe Absatz 4.2.1 und 4.2.2), interessierten sich die Autoren der Studien zur Überprüfung der subletalen Auswirkungen im Freiland ebenfalls für die Beobachtung der Aktivität und des Verhaltens des Honigsammelns der Bienen, die sich direkt auf den Blüten befinden.
Resultate
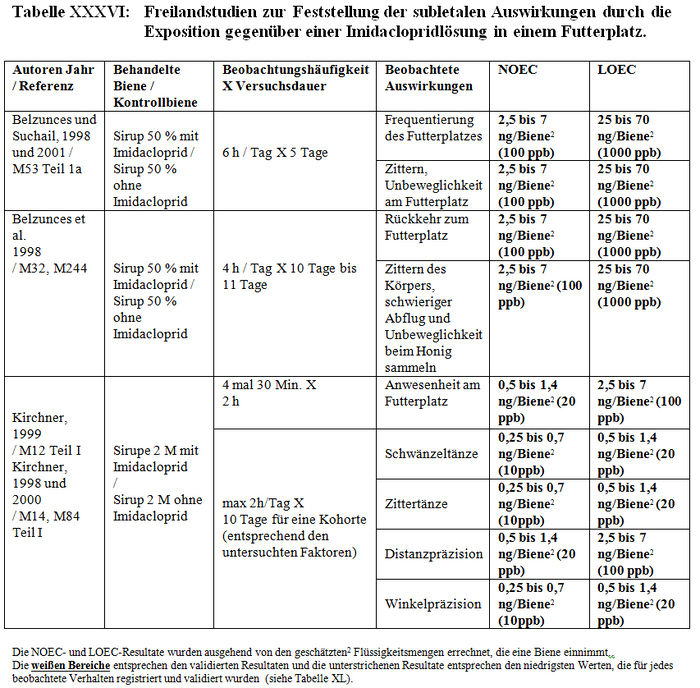
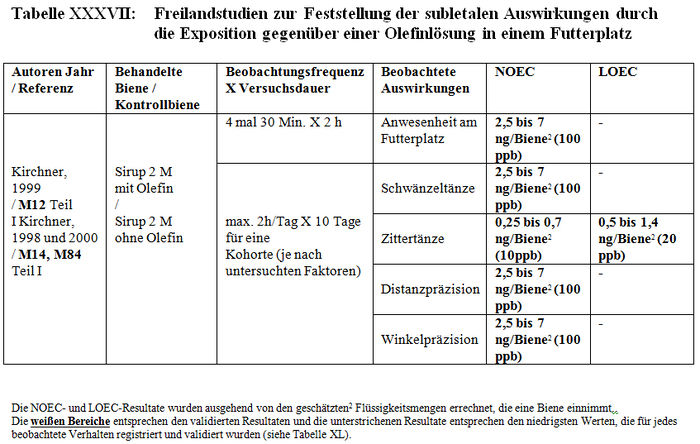
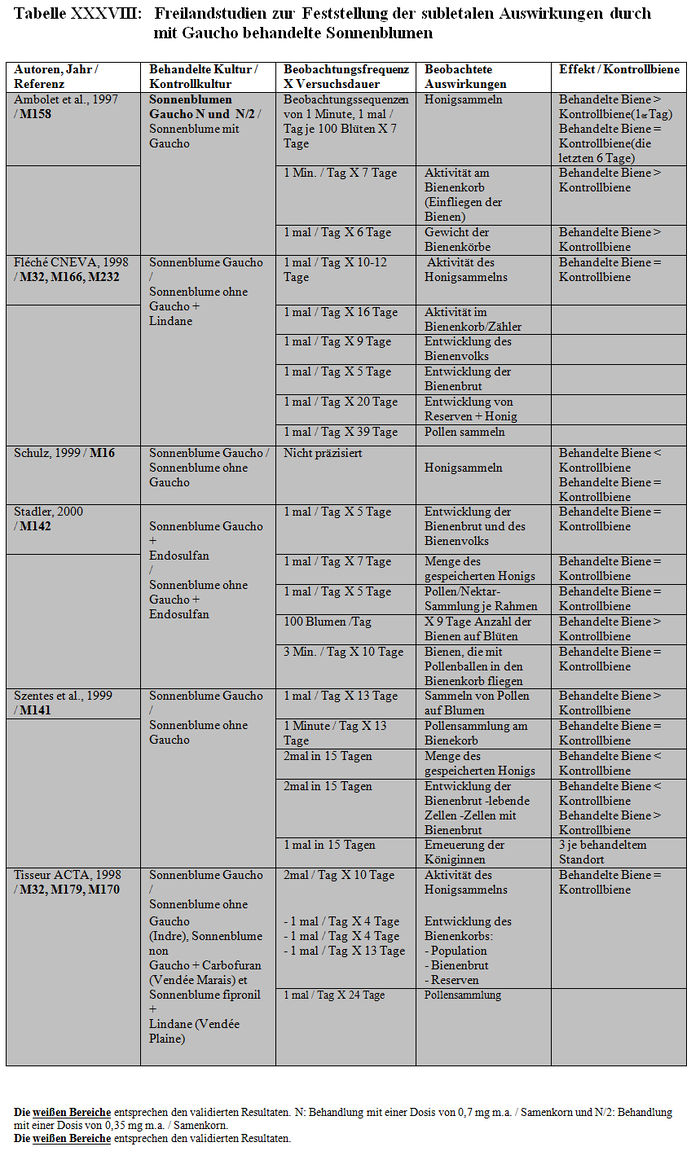
Les Resultate der Studien zur Feststellung der subletalen Auswirkungen im Freiland belegen entweder signifikante Differenzen der Verhaltensweisen zwischen den Bienenlosen, die die behandelten Kulturen nutzen und den Bienen, die die Kontrollkulturen nutzen, oder keine Verhaltensdifferenzen. Die Studien, die signifikante Verhaltensdifferenzen zeigen, haben Folgendes festgestellt: – Zittern und Abflugschwierigkeiten am Futterplatz. Anormale Symptome an den behandelten und Kontrollstandorten, zahlenmäßig jedoch überwiegend an den behandelten Standorten. Unbeweglichkeit und häufiges Herunterfallen der Bienen auf das Flugbrett. (Belzunces und al 1998 und 2001, M53 Teil I a; Belzunces et al. 1998, M32, M244). – Eine höhere Anzahl aktiver Bienen am behandelten Standort als am Kontrollstandort (Ambolet et al 1997, M158; Stadler 2000, M142). Diese Autoren haben 21 und 31 Bienen / 100 Blüten am behandelten Standort gegenüber 7 und 17 Bienen / 100 Blüten am Kontrollstandort festgestellt. Eine Verringerung der Anzahl von Bienen an dem mit zwischen 20 und 100 ppb kontaminierten Futterplatz (Kirchner 1998, 1999 und 2000, M12, M14 oder M84). – Verstohlene Honigsammelaktivitäten am Feld und anormale Nutzung der Blüten (irrational und Unbeweglichkeit auf der Blüte). Die Besuchshäufigkeit an dem 500 m von dem Bienenkorb entfernten Futterplatz verringert sich nach 2 Beobachtungsstunden von 4 Flügen/30 Min. auf 0,8 Flüge/30 Min. (Kirchner 1998, 1999 und 2000, M12, M14 oder M84). In einigen Fällen ist die Pollensammlung auf der Blüte im behandelten Feld höher als im Kontrollfeld (Szentes et al. 1999, M141). – Eine höhere Bienenbrutentwicklung im behandelten Feld im Vergleich zum Kontrollfeld (Szentes et al. 1999, M141). – Eine höhere Honigproduktion im Kontrollfeld als die, die man in den behandelten Feldern erhält. (Szentes et al. 199, M141). In anderen Fällen wurde das Gegenteil beobachtet. (Ambolet et al. 1997, M158). – Eine Verringerung der Zahl und Präzision der Schwänzeltänze (die das Honigsammeln stimulieren) und eine Erhöhung der Zittertänze (die das Honigsammeln hemmen) (Kirchner 1998, 1999 und 2000, M12, M14 oder M84). – Eine Verringerung der Genauigkeit bei der Einschätzung der Entfernungen (gemessen auf +/- 1°) (Kirchner 1998, 1999 und 2000, M12, M14 oder M84). – Eine Erhöhung der Zeit für die Suche nach dem Bienenvolk und der Anzahl der trophallaktischen Kontakte (t-test, p<0,01) (Kirchner 1998, 1999 und 2000, M12, M14 oder M84). – Eine Erhöhung der Honigproduktion während des Tests, höher bei den Kolonien, die sich an den Kontrollstandorten befinden, als bei denen, die sich aan den behandelten Standorten befinden (Schulz, 1999, M16).
b) Validierungskriterien
Die Studien, die in Bezug auf die subletalen Auswirkungen im Freiland durchgeführt wurden, werden validiert, wenn das Protokoll dieser Studien die folgenden Kriterien erfüllt: • Nr. 1: Die Felder müssen so groß sein, dass die Bienen keine anderen Kulturen nutzen (eine Biene nutzt durchschnittlich 6,3 km²). Die Kontrollfelder und die behandelten Felder müssen weit genug voneinander entfernt sein und die Entfernung zwischen ihnen muss bekannt sein. • Nr. 2: Die Kolonien müssen ausgeglichen sein (ca. 10 – 12 Rahmen, 5-6 davon mit Bienenbrut), gesund, normal, gut ernährt, mehr als 4000 Bienen umfassen und einige Tage vor dem Versuch in dem Feld untergebracht werden. • Nr. 3: Es sind mindestens 3 Kolonien / Behandlung notwendig. • Nr. 4: Die Verhaltensstudien müssen mehrere Beobachtungsreihen umfassen, die ordnungsgemäß, vergleichbar und von signifikanter Dauer sind. • Nr. 5: Die behandelten und Kontrollparzellen müssen vergleichbare Bedingungen für die Nektarproduktion aufweisen (Blütezeit, Mikroklima, Bodenvielfalt usw.).
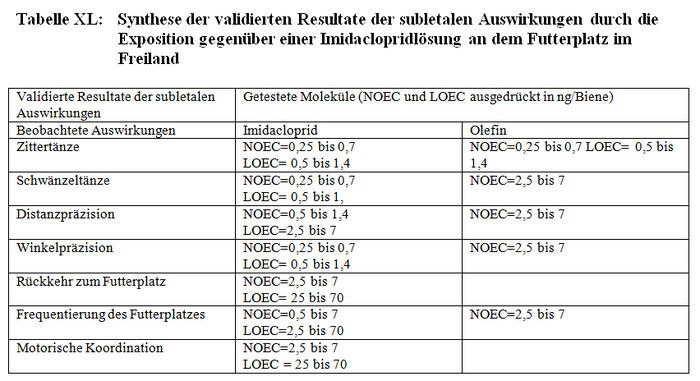
c) Validierte Resultate
Die Resultate der Bewertung der Studien zu den subletalen Auswirkungen bei den Tunneltests sind in Tabelle XL synthetisiert. Die Studienprotokolle, die von den Autoren erbetenen ergänzenden Informationen und ihre Antworten werden jeweils in den Anhängen XXIV, XIX und XX dargestellt.
Die Studien, die die in Absatz 3.2.1 (Teil b) zitierten Validierungskriterien erfüllen, konnten validiert werden und im Gegensatz dazu konnten die Studien, die diese Validierungskriterien nicht erfüllen, aus den im Folgenden präzisierten Gründen nicht validiert werden: – Szentes (1999, M141): Die Konzentration des in dieser Studie verwendeten Imidacloprids ist höher als die homologisierte Dosis (2 mg / Samenkorn anstatt 1 mg / Samenkorn). Das Kontrollfeld ist von Mais- und Sonnenblumenfeldern umgeben (2 km bzw. 1,4 km). Die Bienen können diese Bereiche nutzen. Darüber hinaus vermerken die Autoren das Vorhandensein anderer Bienen als der getesteten Bienen auf den Versuchsparzellen von mehreren zehn Hektar Größe (fremde Bienen und Bienen von einer fremden Imkerei). Auf unsere Bitte nach zusätzlichen Informationen (siehe Anhang XIX) hat der Autor uns die Art der Behandlungen mitgeteilt, die während des Versuchszeitraums in den Gebieten durchgeführt wurde, er hat uns aber nicht über eventuelle Behandlungen mit Gaucho informiert (bei der Aussatz von Kulturen, das heißt lange vor dem Start des Versuchs) (siehe Anhang XX). Da man nicht ausschließen kann, dass die Bienen des Kontrollfelds diese Felder besuchen und da die Behandlungen der Nachbarfelder unbekannt sind, kann man nicht auf die Valididät des Kontrollfelds schließen. Dieselbe Kritik gilt für das behandelte Feld, das ebenfalls von Maisfeldern umgeben ist, von denen die Behandlung bei der Aussatz unbekannt ist.
– Ambolet et al. (1997, M158): die Aktivität des Honigsammelns wurde in dem behandelten und dem Kontrollfeld nicht in dem gleichen Blütezeitstadium gemessen, was zu einer Verzerrung geführt hat (die Blütezeit in dem Kontrollfeld war später und die Aktivität des Honigsammelns ist somit weniger stark als in dem behandelten Feld).
– Fléché (1998, M32, M166, zitiert in M232): Das Protokoll der Studie ist unpräzise. Es gibt keine Informationen über die Behandlungsgeschichte der Standorte. Der mit Gaucho behandelte Standort weist Blattläuse auf den Blütenknospen auf, was die Validität des behandelten Standorts als solchen in Frage stellt. Darüber hinaus weisen die Pollen, die von dem Kontrollfeld stammen, einen Imidaclopridgehalt (zwischen 8 und 14 ppb) auf, was die Validität des Kontrollfeld als solches in Frage stellt.
– Schulz (1999, M16): auf unsere Bitte nach zusätzlichen Informationen über das Protokoll und die Resultate dieser Studie (Anhang XIX) hat uns der Autor eine Erklärung geschickt (Anhang XX). Die Beschreibung der getesteten Standorte ist unvollständig (Entfernung zwischen Kontroll- und behandeltem Feld unbekannt, Kulturarten und durchgeführte Behandlungen der Nachbarfelder nicht definiert). Man kann den Besuch der Bienen auf anderen (behandelt oder nicht behandelt) als den getesteten Feldern nicht ausschließen. Außerdem schreiben die Autoren, dass die an den Kontrollstandorten positionierten Kolonien, je nach Standort, unregelmäßig zum Sammeln anderswo hinfliegen (Bienen an den Kontrollstandorten sammelten mehr Pollen von anderen Pflanzen als Bienen an dem Gaucho-Standort). Somit ist die schwache Honigsammelleistung an dem Kontrollstandort im Vergleich zum behandelten Standort nicht unbedingt eine Folge der Behandlung mit Gaucho. An dem Kontrollstandort bevorzugen die Bienen andere Kulturen zum Sammeln (Honigsackanalysen von Bienen des Kontrollstandorts belegten eine Bevorzugung von blühendem Ölrettich und California bluebell…), wodurch auf diesem Standort eine schwache Aktivität resultiert. Die Aktivität des Honigsammelns wird bei den versammelten Bienen und Hummeln ohne Unterscheidung der Aktivität zwischen den 2 Gruppen gemessen.
– Scott-Dupree und Spivack (2000, M143): Die Studie bezieht sich auf die im Freiland gemachten Beobachtungen. Die Verhaltensbeobachtungen werden in Zeitintervallen von nur 2 Minuten alle zwei Tage durchgeführt (2 Minuten lang jeden zweiten Tag, Seite 7). Diese Dauer ist unzureichend und die mangelnde Regelmäßigkeit in der Beobachtungsfrequenz ist unzureichend. Die Oberfläche der behandelten Felder und der Kontrollfelder (0,1 km² / Standort) ist zu klein und demzufolge ist das Risiko, dass die Versuchsbienen außerhalb dieser Standorte Honig sammeln, sehr groß. Da die Arten der Nachbarkulturen nicht bekannt sind (Kontroll- oder behandelte Kulturen) ist ein Vergleich der Standorte nicht zweckmäßig.
– Stadler (2000, M142): diese Studie stellt ein größeres Problem dar, und zwar ist auf den Kontrollversuchsparzellen Imidacloprid vorhanden, obwohl die Menge des in diesem Boden vorhandenen Imidacloprids nicht festgestellt wurde (< LQ und LQ = 5 ppb, Seite 31).
– Tisseur (1998, M32, M170, zitiert in M232): diese (in 3 Gebieten durchgeführte) Studie beinhaltet zahlreiche Unzulänglichkeiten. Der in der Studie an dem Standort Indre verwendete Bienenzähler verzögert die Defizite der Bienen. An dem Standort Vendée Marais wurden in den Fallen beträchtliche Mengen von Maispollen festgestellt (diese Kulturen sind mehr als 3 km von dem Versuchsbereich entfernt). Der Kontrollstandort in Vendée Plaine wurde mit Regent behandelt. Aufgrund des Verbleibens von Imidacloprid im Boden und unter Berücksichtigung der Tatsache, dass die Böden aller Standorte (Vendée Plaine, Vendée Marais und Indre) im Jahr n-2 mit Gaucho behandelt wurden, kann man das Vorliegen dieses Moleküls in dem Kontrollfeld nicht ausschließen. Außerdem belegt die Analyse des Imidaclopridgehalts in diesen Böden, dass bestimmte Mengen festgestellt wurden (< LQ und LQ = 8 ppb, LD nicht festgestellt, M232, Anhänge, Seiten 1, 5, 8 und 13).
d) Kommentare und Perspektiven
Bedauerlicherweise wurde keine der Freilandstudien in Bezug auf eine Intoxikation durch mit Gaucho behandelte Sonnenblumen oder Mais validiert. Die Studien werfen jedoch das größere Problem der Schwierigkeit auf, mit Sicherheit die Bienen zu beobachten, die sich allein durch die getestete Nahrungsquelle ernähren (Kontrollkultur oder behandelte Kultur). Sie zeigen auch das Problem der Beherrschung der Versuchsbedingungen (Blütezeit, Nektarproduktion usw.), die nicht immer für alle Parzellen identisch sind (Kontrollflächen und behandelte Flächen).
Die Studien, die im Freiland mit kontaminierten Futterplätzen durchgeführt wurden, sind ein guter Kompromiss zwischen den Bedingungen in Tunneln und im Freiland, sofern die Bienen, die sich von den kontaminierten Nahrungsmitteln ernähren, markiert und von den Bienen unterschieden werden, die woanders Honig sammeln. Es ist jedoch hervorzuheben, dass es für diese Art von Studien zahlreiche Unsicherheiten gibt, insbesondere im Hinblick auf die Aktivität des Honigsammelns der Biene außerhalb der Beobachtungszeiträume.
Schlussfolgerungen aus den Studien auf subletale Auswirkungen:
Die im Labor, in Tunneln und im Freiland durchgeführten Studien auf subletale Auswirkungen von Imidacloprid und seinen Rückständen auf die Bienen weisen in methodologischer Hinsicht große Unzulänglichkeiten auf. Es wurden zahlreiche Studien durchgeführt, die streng genommen keine Resultate zeigen: die grafischen Darstellungen sind schlecht, es fehlen Bruttoresultate, die angewendeten Tests und die statistischen Resultate wurden nicht beschrieben. Es gibt wenige Studien, die die Direktiven befolgen, die für Tests in Labors, in Tunneln und im Freiland zur Verfügung stehen. Die Protokolle dieser Studien sind somit unvollständig und die Auswertung der daraus resultierenden Ergebnisse ist schwierig. Es scheint jedoch ebenso wichtig zu sein hervorzuheben, dass eine subletale Auswirkung zu einer letalen Auswirkung werden kann. Wenn eine Honigsammlerin unter Erinnerungsstörungen, Orientierungsstörungen oder physiologischen Störungen leidet, die das Atem- oder Kreislaufsystem beeinträchtigen, kann sie ihren Bienenkorb nicht wieder finden. Sie stirbt also schnell an Hunger oder Kälte. Subletale Auswirkungen sind in diesem Fall nicht das, was sie zu sein scheinen.
Zusammenfassung und Empfehlungen in Bezug auf die Toxizitätsdaten von Imidacloprid und seinen Metaboliten
Akute Intoxikation (1 einzige Applikation)
Zusammenfassung der Validierungskriterien
OCDE-Richtlinie 213 Intoxikation durch orale Applikation) 214 (Intoxikation durch topische Applikation)
Intoxikation durch orale Applikation
Imidacloprid:
Anzahl der Studien: 10
Invalidierte Studien: 0
Validierte Resultate: DL50: von 4 bis 71 ng Imidacloprid/ Biene
Metaboliten
Anzahl der Studien: 4
Invalidierte Studien: 0
Validierte Resultate: DL50 von 28 bis >35,7 ng Olefin/Biene
DL50 von 153 bis 258 ng Hydroxy-Imidacloprid /Biene
DL50 >1000 ng andere Metaboliten/Biene
Intoxikation durch topische Applikation
Imidacloprid:
Anzahl der Studien 8
Invalidierte Studien: 0
Validierte Resultate: DL50: de 6,7 bis 242,6 ng Imidacloprid /Biene
Chronische Intoxikation
Zusammenfassung der Validierungskriterien
– -Nr. 1: Haltungsbedingungen für die Bienen: Dunkelheit, Raum klimatisiert bis 25°C ±2°C und 50 bis 70% relative Feuchtigkeit. – -Nr. 2: Angabe von Alter, Rasse der Biene, Versuchsdatum und Erfassungsmethode. – -Nr. 3: Mindestens 10 Bienen je Käfig, mindestens 3 Käfige je getesteter Dosis, der Test muss dreimal wiederholt werden, eine Gruppe Kontrollbienen und mindestens 3 verschiedenen getestete Dosierungen. Testdauer: 10 Tage – -Nr. 4 Registrierung der Mortalität alle 24 oder 48 h. Mortalität der Kontrollbienen nach Ablauf von 10 Tagen unter 15%.
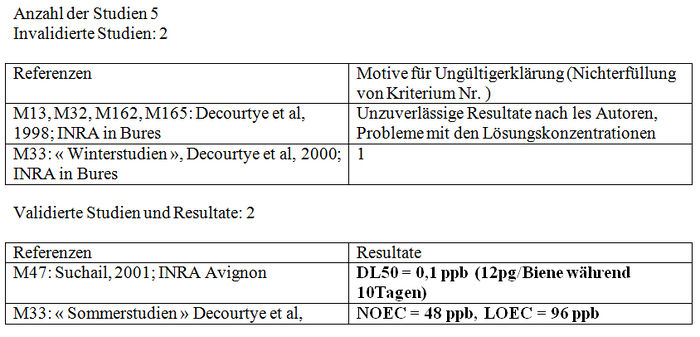

Nicht bewertete Studie: 1
Intoxikation infolge wiederholter oraler Applikation der Metaboliten von Imidacloprid (Chronische Intoxikation)
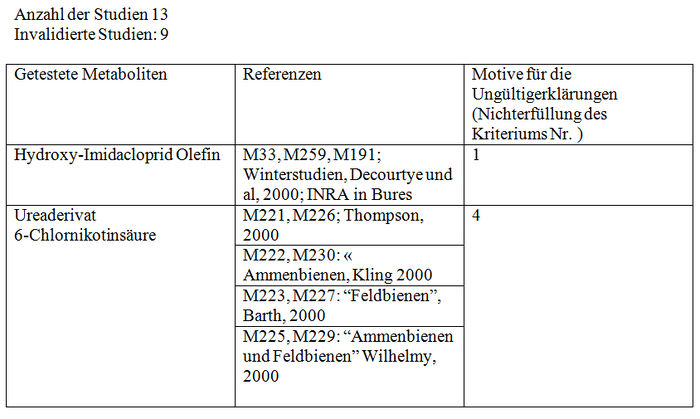
Validierte Studien:
Subletale Auswirkungen
Laborstudien, Intoxikation durch wiederholte Applikation
Zusammenfassung der Validierungskriterien:
– Nr. 1: Schutz des Imidacloprid vor Licht. – Nr. 2: Angabe der auf die Bienen applizierten Imidaclopridmengen. – Nr. 3: Guter physiologischer Zustand der Bienen. – Nr. 4: Mindestens 30 Bienen in 3 Losen. Testdauer: 10 Tage. – Nr. 5: Mortalität der Versuchsbienen nach Ablauf von 10 Tagen unter 15%. – Nr. 6: Vorherige Fastenzeit: 2 bis 4 Stunden.
Studien im Flugkäfig und in Tunneln, Intoxikation durch wiederholte Applikation
Zusammenfassung der Validierungskriterien: – Nr. 1: Schutz des Imidacloprid vor Licht – Nr. 2: Korrekte Abmessungen der Flugkäfige – Nr. 3: Homogenität der Bienenkörbe und ausreichende Entwicklung der Bienenbrut. – Nr. 4: Mindestens 4000 Bienen, wenn die Studie sich auf die Aktivität der Kolonne bezieht. – Nr. 5: Signifikante Beobachtungsdauer.
Freilandstudien
Validierungskriterien:
– Nr. 1: Fläche der Felder wichtig, ausreichender Abstand zwischen behandelten Feldern und Kontrollfeldern. – Schutz des Imidacloprid vor Licht. – Nr. 2: Mindestens 4000 Bienen in gutem physiologischen Zustand, die einige Tage vor dem Versuch in dem Feld ausgesetzt werden. – Nr. 3: Mindestens 3 Kolonien/Behandlung – Nr. 4: Signifikante Beobachtungsdauer – Nr. 5: Behandelte und Kontrollfelder mit den gleichen nektarspezifischen Bedingungen